












BÒ Y TẾ
crc QUẢN LÝ DƯỢC
ĐÃ HÊ DL'YỆT
' Lân đauCỒJJỈOnZDịS
VMUEĐHV NI 3CMI
ĐWO NMQSỉHd
l!^ [ lIIIIICJ
…đảắ’ẳ'ảắâ'ẩỉẩ'ả'mm SAME SIZE ARTWORK
CRT SIZE: 42 mm x 75 mm x 42 mm
Í moummlư cuumsmun G Clutlon - Motoxlc Isent.
Ẹ'ẢẢ'Ể'Ễ' WM » Po amd 500 i Carefully md me inun before use
ơn 10 un mu … ml
- › IMIGIM mbn—lmllccllon, doup &
Em . 1 .
qlenmank …zư:…,…… qlenmank .……………
smme smmmm.mm. | xmwrưmu or…u
Rx Prescripũon Medicine Specitìcaũon: In home
Rl'uhửthlmduu l'lllsmodcìmbmlyavalhbhonmodlul
l…mmmmmmmnm pmcripdon andlu uunumnolbe
ủiưủqưùrhdơuhnuơu rupulodeanuprmíplbn.
eme \ ungmem eme Medicindpmdudwhorizadby
1 MMI ' … M_ Ti_u ủir Mi_dl ú me Argentina M'nSơy d Heallh (A.N.MA.T.)
ị ỮỈM, ỬỈM.Uk UlldÙÙẸ wa Ne 5.43
Pemeưexed_ Xnmửfưmưủìumwấn Pemẹtreạed_
for injection ' ' …… …WM ° íor1nỵechon MWWUW 61²
Pm_twm M m mạ ịumui Mù e…na S.A.
mmgmmmmmmdum. Cah9 Meyer Oks N'593
…ưưưưaaưă czưmư… ffR…ư:ọmcmf … …P,…f
V . , .
nqqẵụmmpz _ Ở 8 Nres.Argemma
Fu imnvenous un dy Ìả'ẵầ HSỂIỀIXZỂq ut”… W Fu ìntnvems uu only www.g .gm_m
Single uu only WM“ iỉụDủ'lùimu Singh uu only Mn rod fư
suúumnammu … uml " ' I | In
_ mamtmụmn°m-mmm _
cạm: l v1al meu'ndnùmnA'm w. cmm: 1 vũ M MWW Cth
PRESCRIVHON DRUG … PRESCRIPTION DRUG 22. BmhữmìDm1Roaứ
MADE N ARGENTINA cchưm ủ' mMWỦNWỦI'IMÙM MADE IN ARGENTINA W…bd ~400026. hdn
Rx Prescription Medicine
Pemehupe
Pemetrexed
for injection
500 mg
qlenmank
STERILE LYOPHILIIED POWDER
PRESERVATIVE FREE
Quali-quantitalive compnsitinn:
Each via! contains:
Pemetrexed disodium equivalent 10
Pemetrexed 500 mg
Excipients q.s.
Store in a dry place, below 30°C.
KEEP OUT OF REACH OF CHILDREN
lndication coutra-indiuation, dosaqe
& ad ' lratiun: see packinsert
Garefu r theinsertbefore use
Spefflgation: In house
Reg.Nofỉ~
Manulactured at:
Glonmark Genetics S.A.
Calle 9 Ing. Meyer Oks N° 593
Parque Industrial Pilar,
Provincia de Buenos Aires,
Argentina
Manufactured for:
Glenmark Pharmaceuticals Ltd.
Bl2. Mahalaxmi Chambers,
22. Bhulabhai Desai Road,
Mumbai - 400026, lndia
Batch No.:
Mfg. date: dd/mm/yyyy
Exp. date: ddlmmlyyyy
HƯỞNG DĂN SỬ DỤNG
Rx
Thuốc nảy chỉ bán theo đơn cùa bảc sỹ _ _
Đọc kỹ hướng dẫn sử dụng trước khi dùng ~ _\
Muốn biết thêm thông tin chi tiết xin hỏi Bác sỹ hoặc Dược ,cỹ«` A __
1’17/ vỉ… PHOr G
PEMEHOPE 500 Đ~'…' ,_ N .
(Bột đông khô pha tiêm Pemetrexed 500 mg) ( h uổTlỄ-JỈJW 1 .
THÀNH PHẢN: Mỗi lọ bột đông khô pha tiêm có chứa: \\—
Hoạt chất: Pemetrexed dinatri tương dương với Pemetrexed ................... 500 mg J’i
Tá dược: Mannitol, Natri hydroxid hoặc Acid Hydroclorid.
DẠNG BÀO cnÊ: Bột đông khô pha dung dịch tiêm truyền.
QUY CÁCH ĐÓNG GÓI: Hộp 1 lọ x 30m1
DƯỢC LỰC HỌC:
Pcmetrexed là một chất antifolat chứa nhân pyrrolopyrimidin- dựa trên những tác động cùa chất
chống ung thư bằng cảch lảm gián đoạn quá trình trao đổi chất folate phụ thuộc cần thiết cho tải tạo
tế bảo Trong nghiên cứu invitro pemetrexed ức chế thymidylate synthase (TS), dihydrofolate
reductase (DHFR) vả glycinamide rỉbonucleotide formyltransferase (GARFT), tất cả các enzym phụ
thuộc folat liên quan dến sinh tống hợp novo cùa thymidỉn vả purin nucleotide. Pemctrexed được
vận chuyến vảo trong tế bảo bằng chất mang folat giống như những hệ thông vận chuyên protein có
gắn kết với folat mảng. Khi vảo trong tế bảo, pemetrexed được chuyến đổi sang dạng polyglutamat
bời enzym folylpolyglutamate synthetase. Cảc dạng polyglutamat được giữ lại trong tế bảo như là
những chẩt ức chế TS vả QARFT. Quả trinh polyglutamat lả một quá trình phụ thuộc thời gian và
nồng độ xảy ra ở những tê bảo u vả, đến mức thấp hơn trong mô bình thường. Chất chu ến hóa
polyglutamat có thời gian bán hủy nội bảo dải dẫn đến gia tảng thời gian tác dụng của thuoc trong
cảc tế bảo ác tính.
Những nghiên cửu tiền lâm sảng cho thấy rằng Pemetrexed ức chếsự phảt triến dòng tế bảo
mesothelioma trên in vitro (MSTO-2l lH, NCL-H2OS2). Những nghiên cứu với dòng tế bảo MSTO-
21 1H mesothelioma cho thấy tảc động hiệp đồng khi pemetrexed kết hợp đồng thời với cisplatin.
Số lượng bạch cầu trung tính (Absolute neutrophil counts) (ANC) sau khi sử dụng pemetrexed như
lá thuốc đơn độc cho những bệnh nhân không bổ sung acid folic vả vitamin đặc trưng sử dụng
những phân tích dược động học dân sô. Mức độ độc tính huyết học được qu 1_định bới dộ điếm
thấp nhắt ANC, tỉ lệ nghịch với diện tích dưới đường cong của Pemetrexed. Người ta cũng quan sảt
những bệnh nhân có nông độ cystathionine hay homocysteine cơ bản cao có ANC thấp hơn. Mức độ
các chất nảy có thế được giảm xuông bời cung cấp folic acid vả vitamin B12. Không có ảnh hưởng
lũy tích đến diện tích dưới đường cong cùa pemetrexed trên ANC thấp nhất được quan sát trên nhiều
đợt điều trị.
Sau khi tiêm pemetrexed, thời gian để ANC đạt mức thấp nhất dao động từ 8-9,6 ngảy với liều 38,3-
316,8 mg ~ giờ 7 mL. ANC trở về ban đẫn khoảng 4,2-7,5 ngảy sau tính từ thời điểm ANC thắp nhất.
DƯỢC ĐỌNG HỌC
Dược động học của đơn trị liệu pemetrexed với liều từ 0,2 to 838 mg/m2 truyền tĩnh mạch trên 10
phút được khảo sảt ở những bệnh nhân bệnh ung thư có những khối 11 đặc khảo nhau. Pemetrexed
không được chuyển hóa trong phạm vi rộng và dược đảo thải chủ yếu trong nước tiều, vởi 70% đến
7/15
90% liều được hồi phục không dồi trong 24h đầu sau khi sử dụng. Độ thanh thải hệ thống cùa
pemetrexed iả 91,8 mL/phủt và thời gian bản hùy của pemetrexed là 3,5 giờ ở những bệnh nhân có
chức năng thận bình
thường (độ thanh thải creatinine 90 le phút). Khi chức năng thận giảm (độ thanh thải giảm), diện
tỉch dưới đường cong (AUC) tăng. Diện tích dưới đường cong pemetrexed (AUC) vả nồng độ huyết
tương tối đa (Cmax) tăng tỉ lệ vởi liếu Dược động học của pemetrexed không thay đổi trên những
chu kỳ (đợt) điều trị. Pemetrexed có thể tích phân phối hằng định là 16,1L. Trong những nghiên cứu
in vitro cho thẳy rằng pcmetrexed liên kết với proteins huyết tương khoảng 81%. Sự liên kết nảy
không bị ảnh hưởng mức độ suy thận
Dược động học của pemetrexed trong những đối tượng đặc biệt đã được kiếm tra với các bệnh nhân
trong một nghiên cứu đơn có mục đích và có kiểm soát.
Bệnh nhân lớn tuổi _ ,
Không thắy ảnh hưởng cùa tuổi tảc trên dược động học của pemetrexed trong 26 đên 80 tuôí.
Trẻ em
Những bệnh nhân nhi không được khảo sảt trong nhũng nghiên cứu lâm sảng.
Giới tính
Dược động học cùa pemetrexed không khảo biệt giữa nam và nữ.
Chủng tộc
Dược động học của pcmetrcxed ở những bệnh nhân da trắng tương tự những bệnh nhân người gốc
Phi. Không có những dữ liệu có giá trị đầy đủ khi so sảnh dược động học của những nhóm chùng tộc
còn lại.
Ở những bệnh nhân suy gan — Không ghi nhận tăng AST (SGOT), ALT (SGPT) hay bilirubin toản
phần trên dược động học của pemetrexed. Tuy nhiên, những nghiên cửu trên bệnh nhân suy gan
không được kiểm soát, như những bệnh nhân có bilirubin >1,5 lần giới hạn trên cùa bình thường
hoặc những bệnh nhân có transaminase > 3,0 lần giới hạn trên của bình thường, hoặc cả 2 nhóm
bệnh nhân nảy nhưng không có bằng chứng di căn gan, hoặc những bệnh nhân có transaminase > 5,0
lần giới hạn trên cùa binh thường vả di căn gan.
Những bệnh nhân suy thận
Những phân tích dược động học được khảo sảt trên những bệnh nhân có suy thặn. Độ thanh thải
huyết tương cùa pemetrexed giảm khi có mặt cisplatin khi chức năng thận giảm,«v ụ gia tăng diện
tích dưới đường cong Những bệnh nhân có độ thanh thải creatinine là 45,50 vhỄílịmL/phủt có sự
gia tảng tương ứng 65%, 54% vả 13% toản bộ diện tích dưới đường cong (AUC ' ' độ thanh thải
creatinine là 100 mL/phút.
CHỈ ĐỊNH ạIỀU TRỊ: '
Ung thư phôi loại tế bâo lớn (không nhỏ) không phãi tế bảo vảy (không vảy) - kết hợp với
Cisplatin
Pcn1ctrexcđ được chỉ định kêt hợp vởi cisplạtin trong điều trị khởi đầu những bệnh nhân ung thư
phôi loại tế bảo lởn (không nhò) không phải tê bảo vảy tăng sinh tại chỗ hoặc có di căn.
Ung thư phổi loại tế bâo iớn (không nhỏ) không phải tế bảo vảy - Duy trì
Pemetrexed được chỉ định trong điếu trị duy trì những bệnh nhân ung thư phồi loại tế bảo lớn (không
nhỏ) không phải tế bảo vảy có tăng sinh tại chỗ hoặc có di căn mả bệnh không tiến triến sau 4 chu kỳ
platin— dựa trên hóa trị liệu bưởc đầu.
Ung thư phổi ioại tế bâo lớn (không nhỏ) không phải tổ bâo vảy- Sau hóa trị liệu trước đó
Pemetrexed được chỉ định như là Lhuốc đơn đề điêu trị cho những bệnh nhân ung thư phối loại tế bảo
lớn (không nhó) không phải tế bảo vảy tãng sinh tại chỗ hoặc có di cản sau đợt hóa trị liệu trước đỏ.
2/75
U trung biễu mô
Pemetrexed kết hợp với cisplatin được chỉ định trong điều trị những bệnh nhân bị u trung biếu mô
phổi’ ac tính là bệnh khỏng thế được điều trị bằng phẫu thuật cẳt bỏ.
Giới hạn sử dụng
Pemetrexed không được chỉ định cho điếu trị những bệnh nhân ung thư phồi loại tế bảo lớn (không
nhò) tế bảo vảy.
LIÊU LƯỢNG VÀ CÁCH SỬ DỤNG.
Pemetrexed chỉ được dùng để tiêm tĩnh mạch
Pemetrexed phải được sử dụng dưới dưới sự kiếm soát chặt chẽ của bảo sỹ có kinh nghiệm trong
việc sử dụng những thuốc chống tăng sỉnh.
Sử dung kết hon với Cisnlatin:
Liều Pemetrexed được khuyến cáo là 500 mg/m2 cho qua đường truyền tĩnh mạch trên 10 phủt vảo
ngảy thứ nhất của mỗi chu kỳ 21 ngảy. Liều khuyến cảo của cisplatin là 75 mg/m2 cho qua đường
truyền tĩnh mạch trên 2 giờ, được bắt đằu khoang 30 phút sau khi kết thủc truyền Pemetrexed, vảo
ngảy đầu tiên cùa mỗi chu kỳ 21 ngảy. Nhũng bệnh nhân nảy nên được điều trị thuốc chống ói và bù
nước thich hợp sau khi vảf hoặc trước khi dùng cisplatin.
Sqử dung đơn tri liêu: ` ` '
0 những bệnh nhân ung thư phôi đã có hóa trị liệu trước, liêư_ khuyên cảo cùa Pemetrexed lả 500
mg/m2 truyẽn tĩnh mạch trên 10 phút trong ngảy thứ nhât cùa môi chu kỳ 21 ngảy.
Các thgổc chnẺt bì chế đồ điều tri:
Corticosteriod
Đỏ da được bảo cáo thường gặp trên những bệnh nhân không được điều trị bằng corticosteroid trước
đây. Việc điều trị trước bằng dcxarnethasone (hoặc tương đương) Iảm giảm tỉ lệ và mức độ phản ứng
da. Trong những nghiên cứu lâm sảng, cho 4 mg dexamethasone bằng đường uống 2 lần một ngảy
vảo các ngảy trước, ngảy dùng thuốc vả 1 ngảy sau khi dùng Pemetrexed.
Bổ sung Vitamin
Để giảm độc tính cho nhũng bệnh nhân đang điều trị vởi Pemetrexed nên cho một liếu thấp bằng
đường uống gồm acid folic hoặc hỗn hợp vitamin có acid folic. Trong suốt 7 ngảy trưởo liều đẩu
Pemetrexed, nên cho ít nhất 5 liều acid folic; vả uống tiếp tục đầy đủ trong chu kỳvdùng thuốc vả 21
ngảy sau khi tiêm liều Pcmetrcxed cuối cùng Tiêm bắp 1 liều vitamin B12 trbtỄ\tuằn dùng liều
Pemetrexed đằu tiên và trong 3 chu kỳ tiếp theo. Những lần tiêm vitamin Blz saMcb'thể được cho
cùng ngảy dùng Pemetrexed. Trong những nghiên cứu lâm sảng, liều acid folic nghiên cứu từ 350
đến 1000 ụg, vả liều vitamin Blz là 1000 ụg. Hầu hết liều acid folic đường uỏng sử dụng trong
nghiên cứu lâm sảng lả 400 ụg.
Những khuvến các cho then dõi thử nghỉêm vả giãrn liều , _ `
Theo dõi — Đêm sô Iượng tế bảo mảu toản bộ, bao gôm đêm tiêu câu, phải được thực hiện ở mọi
bệnh nhân sử dụng Pemetrexed. Bệnh nhân phải được theo dõi điêm thâp nhât và sự hôi phục, được
đánh giá trong nghiên cứu lâm sảng trước môi liêu vả vảo ngây 8 và 15 cùa môi chu kỳ. bệnh nhân
không phải bắt đầu một chu kỳ điều trị mới trừ khi số lượng neutrophil 21,500 tế bảoỉmmẵ tiểu cầu
đếm lả 2100,000 tế bảo/mm3, và độ thanh thải creatinine 245 lephút. Những test hóa mảu phải
được thực hiện định kỳ đê đánh giá chức năng gan và thận.
3/15
Bilỉrubin toản phần phải <1 5 lần giới hạn trên bình thường Alkaline phosphatase (ALP), aspartate
transaminase (AST or SGOT) vả alanine transaminase (ALT or SGPT) phải <3 lần giới hạn trên
bình thường. Alkalìne phosphatase, AST, vả ALT <5 1ần giới hạn trên binh thường là có thể chấp
nhận được nếu như có ảnh hưởng giả u trên gan
Những khuyến cáo giảm liều - Điều chinh liều vảo đầu chu kỳ tiếp theo phải căn cứ vảo con số thẳp
nhất cùa sô lượng tế bảo mảu cùa chu kỳ điếu trị trước đó Điều trị có thế bị trì hoãn đế có đủ thời
gian phục hồi. Khi phục hồi, bệnh nhân nến được điếu trị lại sử dụng cảc khuyến cảo trong bảng
dưới đây, được ảp dụng cho Pemetrexed đơn trị hoặc kết hợp với Cisplatin
Bâng: Giảm liều điều trị Pemetrexed (trong đơn trị liệu hoặc kết hợp) và Cisplatin - Độc tính
huvết học , ,
Số lượng bạch cầu trung tỉnh thẳp nhất <500/mm3 vả 75%1iêutrước dó (cả 2 thuôo)
số lượng tiếu cầu thấp nhất >50, OOO/mm3
Số lượng tiều cẳu thấp nhất <50, OOO/mm3 bắt kể số 75%1iếutrước đó (cả2 thuốc)
lượng bạch cầu trung tính thấp nhất là bao nhiêu
Số_lượngf tiến cần thấp nhất <50.000/mm3 kèm tth 50% liều tfưỚc đó (CảZ thuốc)
xuật huyêt, bât kê số lượng bạch câu trung tính thâp
nhât là bao nhiêu
Nếu bệnh nhân có dấu hiệu nhiếm độc không phải bệnh lý huyết học (ngoại trừ độc thần kinh)_ >
mức 3, Pemetrexed phải được ngưng cho đến khi mức độ nhiểm độc thấp hơn hoặc bằng mức độ
trưởc khi điều trị. Điếu trị phải được tiếp tục theo hướng dẫn trong bảng dưới đây
Bãng: Giãm liếu điều trị Pemetrexed (trong đưn trị liệu hoặc kểt hợp) và Cisplatin - Độc tỉnh
huyết họca› b
Liều Pemetrexed (mglm²) Líều Cisplatino (mglm²)
Bất kỳ độc tính mức 3 hoặc 4,
. , ., .. 75%liềutrướcđó
ngoạn trư v1em mem mạc
75%1iếutrước đó
Bất kỳ tiêu chảy cần nhập
… ~ , … 7 0/ 11² trư'cđó
v1ẹn hoạc mưc3hoạc4 5 ° eu 0
75% liếu Irước đó
500/o liếu trưởo đó
Viêm niêm mạc mức 3 hay 4 100% liễữỔrịlổc đó
a NCI Common Toxicity Criteria (CTC): Tiêu chuẩn độc tính chung
b Excluding neurotoxicity: Không gồm độc thần kinh
Trong trường hợp bị ngộ độc thần kinh, liếu thuốc được khuyến cáo cho Pemetrexed vả Cisplatin
được mô tả trong bảng bên dưới. Bệnh nhân phải ngừng điếu trị nếu xảy ra nhiềm độc thần kinh ở
mức 3 hoặc 4.
Bảng: Giã… liếu đỉếu trị Pemetrexed (trong đơn trị liệu hoặc kết hợp) và Cisplatỉn - Độc tính
thân kinh
Mức CTC Liễu Pemetrexed {mglmz) Liều Cispiatino (mglm2)
01 100% liều trước đó 100% liếu trưởc đó
2 100% liêu trước đó 50% liếu trước đó
F) _
Điều trị Pemetrexed nên ngưng nếu bệnh nhân có bất kỳ dấu hiệu độc tính nảo 1iên quan bệnh lý
huyết học hoặc không thuộc bệnh lý huyết học mức 3 hoặc 4 sau 2 lần giảm liếu, hoặc phải ngưng
ngay lập tức nếu thấy dấu hiệu độc thần kinh mức 3 hoặc 4.
Bệnh nhân lởn tuối
Ngoài những khuyến oác giảm liếu cho tất cả cảc bệnh nhân ở trên, không cần giảm liếu cho bệnh
nhân > 65 tuối.
T re em vả thanh Iht'ếu niên
Pemetrexed không được khuyến cáo sử dụng ở những bệnh nhân dưới 18 tuối vì sự an toản và hiệu
quả của Pemetrexed đã không có kết quả ở nhóm bệnh nhân nảy.
Bời vì số lượng bệnh nhân có độ thanh thải creatinin dưới 45 ml | phút thì thẳp, nó không phải là có
thể đưa ra khuyến cảo liều lượng cho nhóm bệnh nhân nảy Do đó, Pemetrexed không nên dùng cho
bệnh nhân có độ thanh thải crcatinin lả <45 ml | phủt bầng cảch sứ đụng công thức Cockcroft vả
Gault (bên dưới) hoặc GRF được tỉnh bởi phương phảp thanh thải huyết tương Tc99m- DPTA:
Nam : 1140 — tuối1 x trong lương cơ thể fKH) = mL/phút
72 x croatinine huyêt thanh (mg/dL)
Nữ: được tính theo công thức độ thanh thải creatinine cho nam x 0.85.
Cần thận trọng khi dùng Pcmetroxcd đồng thời với NSAID cho bệnh nhân có độ thanh thải croatinin
lả <80 ml 1 phút.
Trên những bệnh nhân bị suy gan- Pemetrexed không ohuyến hóa rộng răi ở gan. Bảng 4 cung cấp
bảng điều chinh liều dựa trên mức độ suy gan trong quá trinh điều trị với Pcmetroxed.
CÁCH DÙNG:
C_huẩn bi và thân trong khi sử dung
Cũng như những thuốc chống ung thư oó khả năng gây độc hại khác, cần thận trọng khi xử lý và
chuẩn bị các dung dịch truyền Pemetrexed. Khuyến khich việc sử dụng găng tay. Nếu dung dịch
Pemetrexed tiếp xúc vởi da, rứa sạch bằng nước và xả phòng ngay lập tức. Nếu Pometrexcd tiếp xúc
với mảng nhầy, rừa kỹ bằng nước. Một vải hướng dẫn để xử lý và loại bỏ thuốc ohống ung thư đã
được công bố.
Pemetrexed không phải lả một thuốc lảm phồng da. Không có thuốc giải độc đặc hiệu cho tình trạng
thoảt mạch của Pemetrexed Cho đến nay, rất ít trường hợp thoảt mạch của Pemetrùed đã được bảo
cảo, tình trạng mà chưa được các điều tra viên coi là nghiêm trọng. Tình trạng\ẵhoảt mạch của
Pemetrexed không nên kiểm soát bởi các tiêu chuẩn thực hảnh cơ sở sử dụng vơ1 thữỏo ịgây phổng da
khảo
Chuẩn bi cho tiêm tru_wền tĩnh mach
1. Sử dụng kỹ thuật vô trùng trong quá trinh hoản nguyên vả pha loãng Pemetrexed đế tiêm truyền `
tĩnh mạch.
2. Tinh toán lỉều lượng và số lượng lọ Pemetrexed cần thiết. Mỗi lọ Pemetrexed chứa một lượng dưỂ
nhỏ so vởi lượng trên nhãn để tạo thuận lợi cho việc sử dụng.
3. Hoản nguyên lọ 500 mg với 20 ml dung dịch natri clorid 0, 9% pha tiêm vả lọ 100 mg với khoảng
4 ,2 ml dung dịch natri clorid 0, 9% pha tiêm (không chất bảo quản) đế có được một dung dịch
chứa 25 mg/mL Pemetrexed. Lắc nhẹ nhảng môi lọ oho đến khi bột tan hoản toản. Kết quả được
cảo dụng địch trong vả có mảu sẳc dao động từ không mảu đến mảu vâng hoặc mảu xanh lá mạ
mả không ảnh hưởng xấu đến chẳt lượng sản phầm Cáo dung dịch hoản nguyên của Pomotroxod
oó pH giữa 6, 6 vả 7 ,.8 CÂN PHẢI PHA LOẢNG THÊM.
U
`
5/75
4. Thưốc tiêm phải được kiếm tra bằng mắt các tiếu phân vả sự đổi mảu trưởo khi dùng. Nếu thấy
cảc tiếu phân trong dung dịch, không sử dụng chế phẩm đó
5. Một lượng thích hợp dung dịch hoản nguyên của Pemetrexed phải được pha loãng thêm trong
dung dịch natri olorid 0, 9% pha tiêm (không chắt bảo quản để tổng thể tích dung dịch là 100 ml.
Dung dịch Pometrexcđ nảy được sử dụng truyền tĩnh mạch trong 10 phủt.
6. Dung dịch pemetexeđ hoản nguyên và dung dịch pemetexed tiêm truyền đã được chứng minh lả
ôn định lý hóa lên đến 24 giờ sau khi hoản nguyên ban đầu, nếu được bảo quản trong tủ lạnh
hoặc ở nhiệt độ phòng dưới 25°C. Khi chuẩn bị theo chỉ dẫn, dung dịch hoản nguyên và dung
dịch truyền cúa Pometrexed không được chứa chất bảo quản chống nấm mốc. Bỏ bắt kỳ phần
nảo không sử dụng.
Tương kv
PEMETREXED phải được hoản nguyên vả pha loăng chi với dung dịch natri clorid 0, 9% pha tiêm
(không chất bảo quản). Pemetrexed tương thích với bộ truyền chuẩn polyvinyl clorua (PVC) và túi
đựng dung dịch truyền tĩnh mạch Pemetrexed 1ả chất không tương thích với chất pha loãng có chứa
canxi, bao gồm dung dịch Lactatcd Ringer vả Ringer pha tiếm; do đó, những dung dịch nảy không
được sử dụng. Víệc dùng đồng thời Pemetrexed với chất pha loãng khác ohưa được nghiên cửu vả
do đó không khuyến cáo sử dụng
CHỐNG CHỈ ĐỊNH:
Không được sử dụng Pcmetrexed trong những trường hợp có tiến oăn mẫn cảm với Pemetrexed hay
bất cứ thảnh phần nảo của thuốc
Không tiếp tục điếu trị bằng Pemetrexed trong thời kỳ cho con bú sữa mẹ
Dùng đồng thời vởi vaccine sốt vảng da.
CẢNH BÁO:
Phản ửng di ứng
Tác dụng trên da. Phảt ban đã được bảo cáo. Sử dụng trước các thuốc nhóm corticosteroid lâm giảm
tỷ lệ gặp và mức độ nghiêm trọng của phản ứng dị ửng.
Giảm chức nãne thân
Pemetrexed được đảo thải chủ yếu qua thận. Không cần điếu chinh liếu lượng\mnhững bệnh nhân
có độ thanh thải creatinin > 45 ml/phủt. Bởi vì sô lượng bệnh nhân có độ thanhhhni creatinin < 45
ml/phút lá không đủ do vậy không thể đưa ra khuyến cảo iiều lượng cho nhóm nhân nảy. Do
đỏ, Pemetrexed không nên dùng cho bệnh nhân có độ thanh thải croatinin lả < 45 ml / phút.
Ức chế tủv xương
Pemetrcxed có thể ức chế chức năng cùa tùy xương, với biếu hiện giảm bạch cầu, giảm tiếu cằn,
thiếu mảu hoặc giảm toản thế huyết cầu; suy tùy thường là độc tính liều giới hạn Bệnh nhân cần
được theo dõi suy tủy trong khi điếu trị và không nên dùng Pemetrexed cho đến khi số lượng bạch
cặn trung tính (ANC) trở lại 2 1.500 tế bảo / mm3 vả tiểu cầu đếm 2 100.000 tế bảo 7 mm3. Giảm
1iêu cho chu kỳ tiêp theo được dựa trên điếm thắp nhất ANC, số lượng tiếu cầu, và độc tính không
huyết học tối đa quan sát thấy trong các chu kỳ trước.
Bổ sung Folate vả Vitamin B12
Bệnh nhân điếu trị với Pemetrexed cần được hướng dẫn để dùng acid folic vả vitamin Bu như một
biện phảp dự phòng để gỉảm độc tinh liên quan đến huyết học và GI. Trong giai đoạn III thử nghiệm
lâm sảng, độc tinh tổng thể ít hơn vả độc tính hưyết học và không huyết học ở mức 374 như giảm
6/l5
bạch cầu, giảm bạch cầu trung tính có sốt, vả nhiễm trùng với giảm bạch cầu mức 3/4, đã được bảo
cáo khi acid folic vả vỉtamin Blz được dùng trước khi điều trị.
Phu nữ mang thai
Pemetrexed có thể gây hại thai nhi khi dùng cho phụ nữ mang thai. Pemetrexed gây ra độc tính và
gây quải thai ờ ohuột vởi liều 0, 2 mg/kg (0, 6 mg/m2 ) hoặc 5 mg/kg (15 mg/m2 ) khi tiêm tĩnh mạch
vảo ngảy 6 vả 15 cùa thai kỳ. Pemetrexed gây ra dị tật thai nhi (hóa xương không đầy đủ của xương
sên và hộp sọ)
là 0, 2 mg/kg (khoảng 1/833rd 1iều của con người IV đề nghị trên cơ sở mg/m2 ). Độc tố được đặc
trưng bởi sự gia tăng trong trường hợp tử vong phôi thai và giảm kích thước oủa phôi thai. Không
nghiên cứu Pemetrexed nảo được tiến hảnh trên phụ nữ mang thai Bệnh nhân nữ được khuyến nên
tránh có thai. Phụ nữ có khả năng sinh đẻ nên sử dụng biện pháp trảnh thai có hiệu quả khi điếu trị
Pemetrexed. Nếu bệnh nhân điều trị Pemetrexed trong khi mang thai hoặc dự định có thai, bệnh
nhân cần được thông bảo về những mối nguy hiếm tiếm ẩn cho thai nhỉ.
THẬN TRỌN G
Pemetrexed được sử dụng điều trị ung thư dưới sự kiếm soát chặt chẽ cùa bác sĩ có kinh nghiệm
Đếm số lượng tế bảo máu, bao gôm số iuợng tiếu cầu nên được thục hiện 0 tất cả cảc bệnh nhân
dùng pemetrexed. Bệnh nhân cần được theo dõi điếm thấp nhất và sự phục hồi; số lượng tế bảo mảu
được theo dõi trước mỗi iiếu vả vảo ngảy 8 và 15 cùa môi chu kỳ điều trị trong cảc nghíến cửu lâm
sảng
Cần được theo dõi định kỳ chức năng thận vả gan
Cảo biến chứng có thế được kiếm soát một cảch thích hợp chỉ khi các phương tiện chẳn đoán vả điều
trị phù hợp và đầy đủ Các tảo dụng phụ iiên quan đến điếu trị do Pometrexcd có thể hồi phục trong
cảc thử nghiệm lâm sâng. Phảt ban da thường xuyên quan sát thấy 0 những bệnh nhân không điều
trị trước với corticosteroid. Điều trị trước vởi dexamethasone (hoặc tương đương) lảm gíảm tỷ lệ
mắc và mức độ nghiêm trọng oủa phản ứng da
Hiệu quả sử đụng Pcmetrexed trên bệnh nhân trản dịch mảng phổi và cố trưởng thì chưa rõ. Ở những
bệnh nhân nảy, việc dẫn lưu dịch trước khi điếu trị Pemetrexed cần được xem xét.
Pemetrexed có thế gãy hại về mặt di truyền. Đản ông trưởng thảnh nến trảnh lảm cha trong khi điều
trị Pemetrexed và 6 thảng sau đó. Biện pháp trảnh thai hoặc tiết chế được khuyến khích.
Vì Pemetrexed có thể gây ra vô sinh, nam giới nên tìm lời khuyên từ bác sĩ được tư vấn về lưu trữ
tinh trùng trưởo khi bắt đầu đìếu trị.
Độc tính Pcmetrexed trên tiêu hóa khi dùng kết hợp với cisplatin, mất nước nghiếrmtitảng có thể xảy
ra. Vì vậy, bệnh nhân nên được điều trị chống nôn đẫy đủ vả mất nước thích hợp t vaư hoặc sau
khi được điều trị /
Gây un g Ihư, đột bỉến và ảnh hưởng trên khả năng sinh sản
Không có nghiến cứu nảo vế gây ung thư đã được tiến hảnh với pemetrexed. Pemetrexed là chất gây
đột biến câu trúc nhiễm sắc thể trong thử nghiệm in vivo về oấu trúc vì nhân trong tủy xương chuột;
tuy nhiên, nó không gây đột biến trong nhiều thử nghiệm in vitro (Thử nghiệm Ames, CHO).
Pemetrexed tiêm tĩnh mạch với liều 0,1 mg/kg/ngảy hoặc 1iếu cao hơn cho chuột đực (khoảng
1/1666 liều khuyến oảo cho người tính theo mglm2) dẫn đến giảm khả năng sinh sản, giảm khả năng
xuất tinh và teo tinh hoản. Sử dụng pemetrexed cho ohuột mang thai dẫn đến giảm trọng lượng thai
nhi, ảnh hưởng tới quá trình hinh thảnh xương không được hoản chinh của một sô câu trúc xương và
hở vòm miệng.
" o 1 v H I . 4 . A . 2 › .
Anh huơng đen kha nang Im xe va đieu kỉuen may moc
7/15
Chưa có nghiên cứu được tiến hảnh. Tuy nhiên, Pemetrexed đã được bảo oảo gây ra mệt mỏi, do đó,
bệnh nhân cân được cảnh bảo để tránh lải xe hay vận hảnh mảy móc
Dùng cho phụ nữ có thai
Nên trảnh sữ dụng Pemetrexed cho cảc phụ nữ có thai do khả năng nguy hiếm cho thai nhi Nghiện
cứu trên động vật thấy có độc tỉnh sinh sản như dị tật hấm sinh và ảnh hưởng khảo trên sự phát triến
thai nhi, quá trinh mang thai hay trước vả sau khi sinh.
Phụ nữ cho con bú
Sự tiết cảc thảnh phần hoạt tinh vả! hoặc cảc chất chuyến hóa trong sữa mẹ
Pemetrexed hoặc cảc ohất chuyến hóa được tiết trong sữa mẹ chưa rõ. Bời vì nhiều loại thuốc được
bâi tiết trong sữa mẹ, vả do khả năng cảc phản ứng phụ có hại của Pemetrexed cho trẻ sơ sinh bú sữa
mẹ, phụ nữ đang cho con bú nên ngừng nên người mẹ điều trị Pemetrexed.
Dùng cho trẻ em
Sự an toản vả hiệu quả của Pemetrexed ở những bệnh nhân dưới 18 tuối chưa được xác định
Dùng cho người cao tuổi
Điều chỉnh liều dựa vảo độ tuối khảo hơn so với nhưng khuyến cảo cho tất cả các bệnh nhân đã
không được yêu cầu.
Giới tỉnh
Điều chinh iiếu dựa trên giới tính khác hơn so với những khuyến cảo cho tất cả cảc bệnh nhân đã
không được yêu cầu.
Vì Pcmetrexcd có thể gây ra vô sinh không thể thay đối, bệnh nhân nam nên tìm lời khuyên từ bảo sĩ
hoặc dược sĩ thông tin vê lưu trữ tinh trùng trước khi bắt đầu điều trị
Dùng cho bệnh nhân suy gan
Bệnh nhân hilỉrubin> 1,5 lần giới hạn trên đã được loại trừ từ các thử nghiệm lâm sảng với
Pcmetrexed Bệnh nhân transaminase> 3, 0 lằn giới hạn trên mức bình thường đã được loại trừ một
cách hệ thống từ cảc thử nghiệm lâm sảng nếu không có bằng` chứng cùa di cãn gan. Những bệnh
nhân có men 3- 5 lần giới hạn trên mức binh thường bao gôm trong thử nghiệm lâm sảng với
Pemetrexed nếu có di cãn gan. Bảng nảy cho thấy những điếu chỉnh liếu dựa trên suy gan khi điếu trị
Pemetrexed.
Dùng cho bệnh nhân suy thận
Pcmetrexed được thải trừ chủ yếu qua thận. Chức năng thận giảm dẫn đến độ thanh ải vả diện tích
dưới đường cong (AUC) Pemetrexed giảm đối vởi cảc bệnh nhân có chức năng t mbỉnh thường.
Dùng đồng thời với cỉsplatin chưa được nghiên cứu ở những bệnh nhân suy thận trtlềủi'nh.
TƯỚNG TÁC VỚI CÁC THUỐC KHẢC VÀ CÁC DẠNG TƯỢNG TÁC
Pemetrexed thải trừ chủ yếu dưới dạng không đối qua thận như một kết quả của lọc cầu thận và bải
tiết ống. Dùng đồng thời cảc thuốc gây độc cho thận (ví dụ như aminoglycosid, thuốc lợi tiếu, các
họp chất bạch kim, và cyclosporin) có khả năng chậm đảo thải Pemetrexed. Những kết họp nảy thải
được sử dụng một oảch thận trọng. Nếu cần thiết, nên theo dõi cần thặn độ thanh thải creatinin.
Mặc dù liều oao NSAID như íbuprofcn (400 mg, 4 iần/ ngảy) vả acid acetylsalicylic (1, 3 mg/ ngảy)
có thế được dùng cùng vởi Pemetrexed ở những bệnh nhân có chức năng thận bình thường (độ thanh
thải creatinin > 80 ml | phủt), nên cần thận trọng khi sử dụng các liều bởi vì chúng oó thế lảm giảm
8/75
I.e
việc loại bỏ Pemetrexed và do đó 1ảm tăng sự xuất hiện cảc tảo dụng phụ do Pemetrexed. Bệnh nhân
suy thận nhẹ đến trung binh (độ thanh thải creatinine 45- 79 ml/ phứt) nên tránh sử dụng đồng thời
Pemetrexed với NSAID 2 ngảy trước vả 2 ngảy sau khi đùng Pemetrexed.
Do thiếu các dữ liệu về thời gian bản thải liên quan đến khả năng tương tảo giữa Pemetrexed vả
NSAID (ví dụ, piroxicam hoặc refecoxỉb), tất cả các bệnh nhân dùng NSAID nên dùng gián đoạn ít
nhất là 5 ngảy trưởo và 2 ngảy sau khi điều trị Pemetrexed. Nếu cần thiết dùng đồng thời một
NSAID, bệnh nhân phải được theo dõi cẩn thận độc tính, đặc biệt là suy tủy, độc tính trên thận và
đường tiêu hóa.
Tuơng rác Ihuờng gặp cho tất cả thuốc gây độc tế bảo
Việc sử dụng điếu trị chống đông là thường xuyên do nguy cơ huyết khối cao ở những bệnh nhân
ung thư Sự thay đổi tinh trạng đông máu trong cơ địa bệnh nhân cao vả khả năng tương tác với
thuốc ohống đông máu và hóa trị liệu yêu câu một tần số tăng INR (International Normalized Ratio)
theo dõi, nêu phải quyết định đề điếu trị bệnh nhân vởi thuốc chống đông mảu
Do tình trạng suy giảm mìễn dịch của bệnh nhân ung thư, việc sử dụng đồng thời cùa thuốc độc với
tế bảo với vaccine không được khuyến cáo (trừ vaccin sốt vảng da, đó là chống chỉ định) cho nguy
cơ mắc bệnh hệ thống, với cảc hiệu ứng có thể gây tử vong. Sử dụng một loại vắc xin bất hoạt nểu
có. (ví dụ, bệnh bại liệt).
Tác nhân hóa trị liệu
Cisplatin (thuốc điều trị ưng thư) không ảnh hướng đến được động học của Pemetrexed vả
Pemetrexed không gây thay đổi dược động học cùa toản bộ platin.
Vitamin
Uống acid folic hay tiêm bắp vitamin Bị; cùng lúc không ảnh hưởng đến dược động học cùa
Pemetrexed
Chuyến hóa !huổc bởi enzyme cytochrome P450
Kết quả nghỉên cứu in vitro trên microsome gan người dự đoán rằng pemetrexed sẽ không gây ra ức
chế quả trinh chuyến hóa thải trừ của chuyển hóa thuốc bởi enzyme CYP3A, CYP2D6, CYP2C9 vả
CYPIA2 có ý nghĩa lâm sảng. Chưa có nghiên cứu nảo xảo định khả năng cảm ứng cùa isoenzyme
cytochrome P450 bới vi Pemetrexed không gây ra bất cứ cảm ứng men nảo có ý nghĩa.
Aspirin
Khi uỏng Aspirin 1iếu thấp hoặc trung bình (325mg mỗi 6 giờ), không ảnh hưởng đến được động học
cùa pemetrexed. Ở iiếu cao (> 1,3g/ ngây), aspirin có thế lảm gỉảm sự bải tiểt pemetrexed và vì vậy
lảm tăng tảo dụng phụ
Thuốc gây độc cho thận:
Tương tảo dược động học có thể xảy ra (lảm chậm thải trừ pemetrexed).
Probenecid n
Tương tác dược động học có thể xảy ra (lảm chậm thải trữ pemetrexed). Tương tảo ổỸ động học
cũng có thể xảy ra với các chất khảo bải tiết ở ống thận. 1 /"
CẢC TẢC DỤNG KHÔNG MONG MUÔN
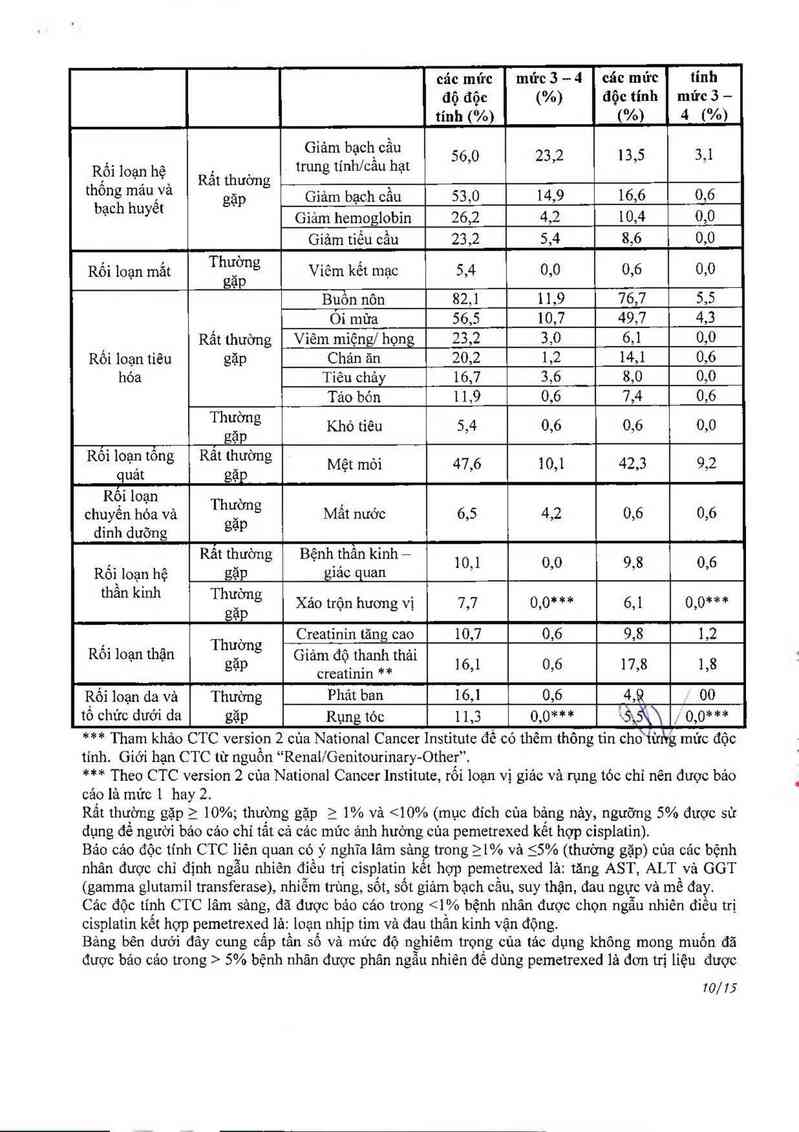
Bảng dưới đây cung cấp tần số và mửc độ nghiếm trọng của tác dụng phụ không mong muốn đã
được bảo cảo trong 5% bệnh nhân bị 11 trung biếu mô được chọn ngâu nhỉên để dùng cisplatin vả
pemetrexed, và bệnh nhân có u trung biếu mô được chọn ngẫu nhiên để dùng cisplatin lá đơn trị liệu
Ớ cả hai nhóm điếu trị, những bệnh nhân không có hóa trị trước được uỏng acid folic vả bổ sung
vìtamin B12
Xếp loại theo Pcmetrexed/Cisplatin Cisplatin
hệ thôngcơ Tẫn số Kết quả* (N=168) (N=163)
quan Tẩtcã | Độc tính Tấtcã | Độc
9/75
các mức mức 3 —— 4 các mức tính
độ độc (%) độc tính mức 3 —
tính (%) 1%) 4 1%)
Giàm,bạ°ht câu 56,0 23,2 13,5 3,1
Rối loan hê , ` trưng t1nh/cau hạt
4 ' , ', Rat thương `
th°ng mau,Va găp Giảm bach câu 53,0 14,9 16,6 0,6
bạch hưyêt ' . , ` .
Giam hemoglobin 26,2 4,2 10,4 0,0
Giảm tiếu oầu 23,2 5,4 8,6 0,0
Rối lơạn mắt Thẩịng Viếm kết mạc 5,4 0,0 0,6 0,0
' Bỉ5n nôn 82,1 11,9 76,7 5,5
Ỏi mứa 56,5 10,7 49,7 4,3
Rất thường Viêm miệng/ họng 23,2 3,0 6,1 0,0
Rối loạn tiêu gặp Chản ản 20,2 1,2 14,1 0,6
hóa Tiêu ohảy 16,7 3,6 8,0 0,0
Tảo bón 1 1,9 0,6 7,4 0,6
Th`ẳờ“g Khó tiêu 5,4 0,6 0,6 0,0
, _ , gạp
R°l loạẳ’ tong Rat `Ềương Mệt môi 47,6 10,1 42,3 9,2
quat gạp
Rễỉ l°ạn Thườn ,
chuyên hóa và ă g Mât nước 6,5 4,2 0,6 0,6
dinh dưỡng g, p
:. , Rat thương Bẹnh than kinh — 1051 00 9,8 0, 6
Roi loạn hẹ gạp giac quan
than kmh Thglẳịng Xảo trộn hương vị 7,7 0,0* ** 6,1 0,0** *
Thường Creatinin tăng cao 10,7 0,6 9,8 1,2
R01 loạn thạn gặp Cnam đợthanẵtha1 ] 6,1 0, 6 17,8 1,8
creatinin
Ẹối loạn da và Thường Phảt ban 16,1 0,6 f1,8 , 00
tô chức dưới da gặp Rụng tỏc 11,3 0,0*** 'a5\5\\ 0,0…
*** Tham khảo CTC ver510n 2 cùa National Cancer Institute đế có thêm thông tin chđt'ừhg mửc độc
tính. Giới hạn CTC từ nguồn “'Renai/Genitourinary-Other”.
*** Theo CTC vorsion 2 cùa National Cancer Institute, rối loạn vị giảc vả rụng tóc chi nến được bảo
cảo là mức 1 hay 2.
Rất thường gặp_ > 10%; thường gặp > 1% và <10% (mục đich cùa bảng nảy, ngưỡng 5% được sử
dụng để người bảo các chỉ tắt cả các mức ảnh hưởng cùa pemetrexed kết hợp cisplatỉn)
Báo cảo độc tính CTC liên quan có ý nghĩa lâm sảng trong >1% vả <5% (thường gặp) cùa cảc bệnh
nhân được chỉ định ngẫu nhiên điều trị cispiatin kết hợp pemetrexed lả: tăng AST, ALT vả GGT
(gamma glutamil transferasc), nhiễm trùng, sốt, sốt giảm bạch cãu, suy thặn, đau ngực vả mề đay.
Cảo độc tính CTC lâm sảng, đã được báo cáo trong <1% bệnh nhân được chọn ngân nhiên điếu trị
cisplatin kết hợp pemetrexed lả: loạn nhịp tim và đau thằn kinh vận động.
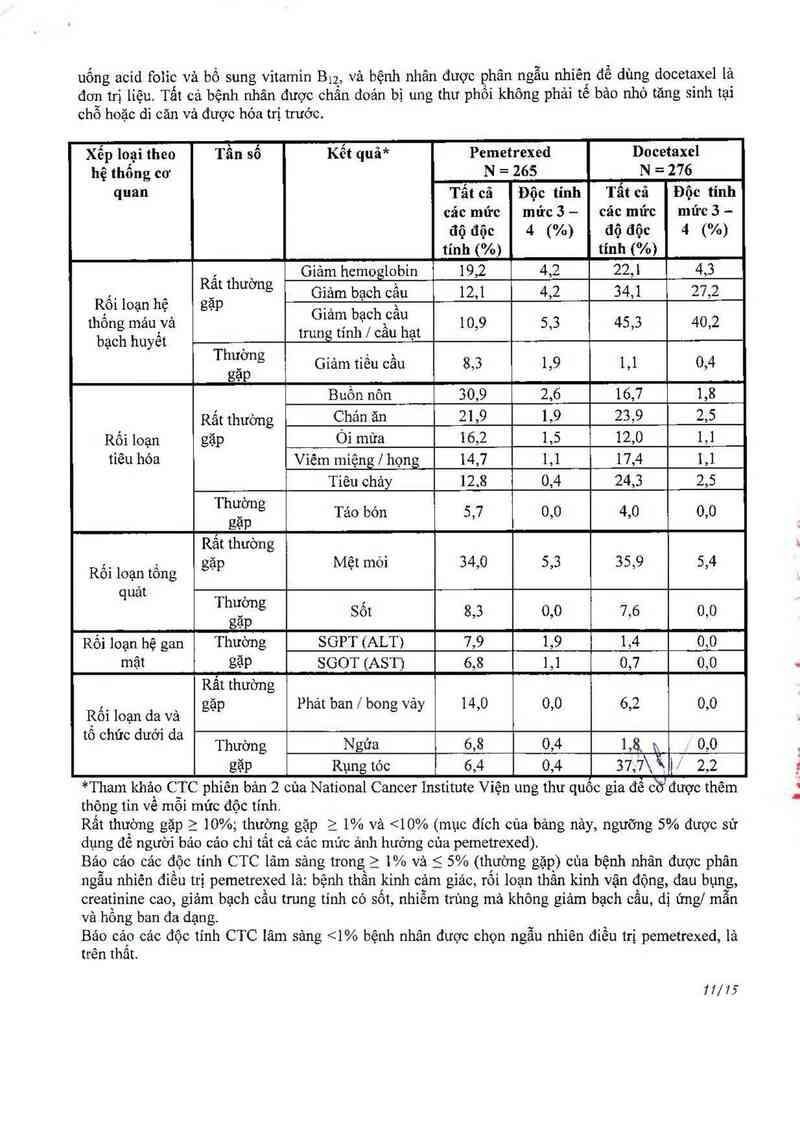
Bảng bên dưới đây oung oâp tần số và mức độ nghỉêm trọng của tảo dụng không mong muốn đã
được bảo cảo trong > 5% bệnh nhân được phân ngân nhiên để dùng pemetrexed lả đon trị liệu được
70/15
uống acid folic vả bổ sung vitamin B12, và bệnh nhân được phân ngẫu nhiên để dùng docetaxel lá
đơn trị liệu. Tất cả bệnh nhân được chẩn đoản bị ung thư phồi không phải tế bảo nhờ tăng sinh tại
chỗ hoặc di căn vả được hóa trị trước.
Xếp loại theo Tần số Kết quả* Pemetrexed Docetaxel
hệ thổng cơ N = 265 = 276
quan Tẩt cả Độc tính Tẩt cả Độc tính
các mức mức 3 — cảc mức mức 3 —
độ độc 4 (%) độ độc 4 (%)
tính (%) tính (%)
, ` Giảm hemoglobin 19,2 4,2 22,1 4,3
… , RẺ“ thương Giảm bạch cầu 12,1 4,2 34,1 27,2
R'ôl loạn hẹ gạp Giảm bach cầu
thông mảư vả , ' ~, 10,9 5,3 45,3 40,2
bach hu ết trung t1nh / cau hạt
. y ,
Thlỉơng Giảm tiếu cầu 8,3 1,9 1,1 0,4
gạp
Buồn nôn 30,9 2,6 16,7 1,8
Rắt thường Chản ăn 21,9 1,9 23,9 2,5
Rối loạn gặp Ói mửa 16,2 1,5 12,0 1,1
tiêu hóa Viêm miệng / họng 14,7 1,1 17,4 1,1
Tiêu chảy 12,8 0,4 24,3 2,5
Thlỉơng Táo bón 5,7 0,0 4,0 0,0
gạp
Rắt thường
Rối loạn tổng gạp Mẹt mm 34,0 5,3 35,9 5,4
quảt ,
Thương Sốt 8,3 0,0 7,6 0,0
gặp
Rối loạn hệ gan Thường SGPT (ALT) 7,9 1,9 1,4 0,0
mật gặp SGOT (AST) 6,8 1,1 0,7 0,0
Rất thường
,, gặp Phát ban | bong vảy 14,0 0,0 6,2 0,0
Ẹôi loạn da và
to Chưc dươ’ da Thường Ngứa 6, 8 0, 4 1 ,8 0, 0
gặp Rụng tóc 6,4 0, 4 37 ,7\Ắ ) 2, 2
*Tham khảo CTC phiên bản 2 cùa National Cancer Institute Viện ung thư quôo gia để cĨỂ được thêm
thộng tin về mỗi mức độc tính.
Rất thường gặp_ > 10%; thường gặp > 1% và <10% (mục đích của bảng nảy, ngưỡng 5% được sử
dụng để người bảo các chỉ tất cả cảc múc ảnh hướng cùa pcmetrexed).
Báo cảo cảc độc tinh CTC lâm sảng trong 2 1% vả S 5% (thường gặp) của bệnh nhân được phân
ngẫu nhiên điếu trị pemetrexed lả: bệnh thần kinh cảm giảc, rối loạn thẩn kỉnh vận động, đau bụng,
creatinine cao, giảm bạch oầu trung tinh có sốt, nhiễm trùng mả khộng giảm bạch cầu, dị ứng/ mẫn
và hồng ban đa dạng.
Bảo cản các độc tính CTC lâm sảng <1% bệnh nhân được chọn ngẫu nhiên điếu trị pemetrexed, lả
ttên thắt.
11/75
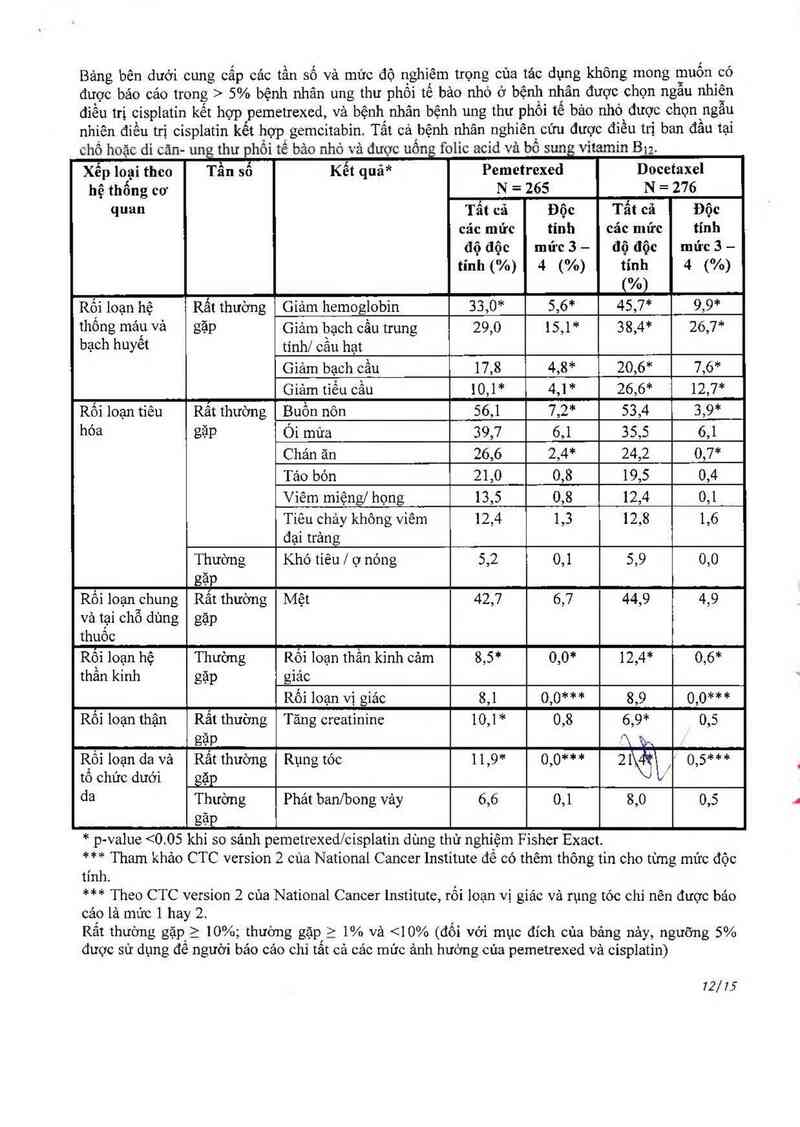
Bảng bên dưới cung cấp cảc tần số và mức độ nghìêm trọng của tâc dụng không mong muốn có
được bảo cáo trong > 5% bệnh nhân ung thư phổi tế bảo nhỏ ở bệnh nhân được chọn ngẫu nhỉên
diếu trị cisplatỉn kết hợp pemetrexed, và bệnh nhân bệnh ung thư phổi tế bảo nhỏ được chọn ngẫu
nhiên điều trị cisplatin kết hợp gemcitabin. Tất cả bệnh nhân nghiên cứu được điều trị ban đầu tại
chõ hoặc di cản- ung thư phổi tế bảo nhỏ vả dược uống folic acid “ả bổ sung vitamin Bư
Xếp loại theo Tần số Kết quả* Pemetrexed Docetaxel
hệ thống cơ N = 265 N = 276
quan Tắt cả Độc Tẩt cả Độc
các mức tính các mức tính
độ độc mửc 3 — độ độc mửc 3 —
tính (%) 4 (%) tính 4 (%)
(%)
Rối loạn hệ Rất thường Giảm hemoglobin 33,0* 5,6* 45,7* 9,9*
thống máư Vả gặp Giảm bạch cầu trung 29,0 15,1 * 38,4* 26,7*
bạch hưyêt tính] cằu hạt
Giảm bạch cầu 17,8 4,8* 20,6* 7,6*
Giảm tìếu cầu 10,1* 4,1* 26,6* 12,7*
Rối loạn tiêu Rất thường Buồn nôn 56,1 7,2* 53,4 3,9*
hóa gặp Ói mửa 39,7 6,1 35,5 6,1
Chản ăn 26,6 2,4* 24,2 0,7*
Tảo bón 21,0 0,8 19,5 0,4
Viêm miệng] họng 13,5 0,8 12,4 0,1
Tiếu chảy không viêm 12,4 1,3 12,8 1,6
đại trảng
Thuờng Khó tiêu / ợ nóng 5,2 0,1 5,9 0,0
, gặP
Rôì loạn_chung Rât thường Mệt 42,7 6,7 44,9 4,9
và tại chõ dùng gặp
thuôo
Rội loạn hệ Thường Rối loạn thần kinh cảm 8,5* 0,0* 12,4* 0,6*
thân kinh gặp giảc
Rối loạn vị giác 8,1 0,0*** 8,9 0,0***
Rối loạn thận Rất thường Tăng creatirĩine 10,1* 0,8 6,9* 0,5
, gặP Ă '€n
R_ôi loạn da vả Rât thường Rụng tóc 11,9* o,o*** 21\Ổ\ 0,5***
tô chức dưới gặp
da Thường Phát banfbong vảy 6,6 0,1 8 0 0,5
gạp
* p-value <0.05 khi so sánh pemetrexed/cisplatin dùng thử nghiệm Fisher Exact.
*** Tham khảo CTC vcrsion 2 của National Cancer Institute đế có thêm thông tin cho từng mửc độc
tính.
*** Theo CTC version 2 cùa National Cancer Institute, rối loạn vị giác và rụng tóc chỉ nên được báo
cáo là mức 1 hay 2.
Rất thường gặp_ >] 10%; thường gặp_ > 1% và <10% (đối vởi mục đích của bảng nảy, nguỡng 5%
được sử dụng để người bảo cảo chỉ tất cả các mửc ảnh hưởng của pemetrexed vả cisplatin)
72/15
Bảo cáo các độc tính CTC liên quan đến lâm sảng trong khoảng 1% đến 5% (thường gặp) của bệnh
nhân được phân ngẫu nhiên điều trị cìsplatin kết hợp pemetrexed lả: tăng AST vả ALT, nhiễm trùng,
bạch cầu trung tính có sốt, suy thận, sốt, mất nước, viêm kết mạc và giảm độ thanh thải creatinin.
Bảo cảo cảc độc tính CTC liên quan đến lâm sảng ở < 1% bệnh nhân được chọn ngẫu nhiến điều trị
pemetrexed kết hợp cisplatìn lả: tăng GGT (gamma glutamil transferase), đau ngực, loạn nhịp tim và
rôi loạn thần kinh vận động.
Đối với giới tỉnh dộc tính trên lâm sảng ở bệnh nhân điều trị pemetrexed kểt hợp vởi cisplatin thì
tương tự.
Kết quả thử nghiệm độc tính mức 3 và 4 liên quan đến lâm sảng thì tương tự gỉữa giai đoạn 2 từ ba
nghiên cửu liều pemetrexed đơn trị vả gìaỉ đoạn 3 nghiên cửu pemetrexed đơn trị mô tả ở trên, ngoại
trừ bạch cầu trung tính (12,8% so với 5,3%) và alanine transaminase cao (tương ứng 15,2% so vởi
1 ,.9%,) Những khảo biệt nảy có thể do sự khảo biệt trong dân số bệnh nhân, bởi vì gỉai đoạn 2
nghiên cứu bao gồm cả bệnh nhân không có hóa trị liệu trưởo vả điếu trị rất nhiều bệnh nhân ung thư
vú di căn từ trước gan vảl hoặc cơ sở xét nghiệm chửc năng gan bất thưòng
Trong nghiên cứu lâm sảng Pemetrexed, thường dùng kết hợp vởi các tảc nhân gây độc tế bảo khảc,
bỉển cô tím mạch nghìêm trỌng, bao gồm cả nhồi mảư cơ tím, đau thắt ngực, tai nạn mạch mảư não
vả thiểu mảư cục bộ thoảng qua, đã được bảo cáo khác thuòng. Nhiều bệnh nhân có cảc yếu tố nguy
cơ tim mạch trước đó. Hỉểm gap các trường hợp viêm gan nghiêm trọng được bảo các
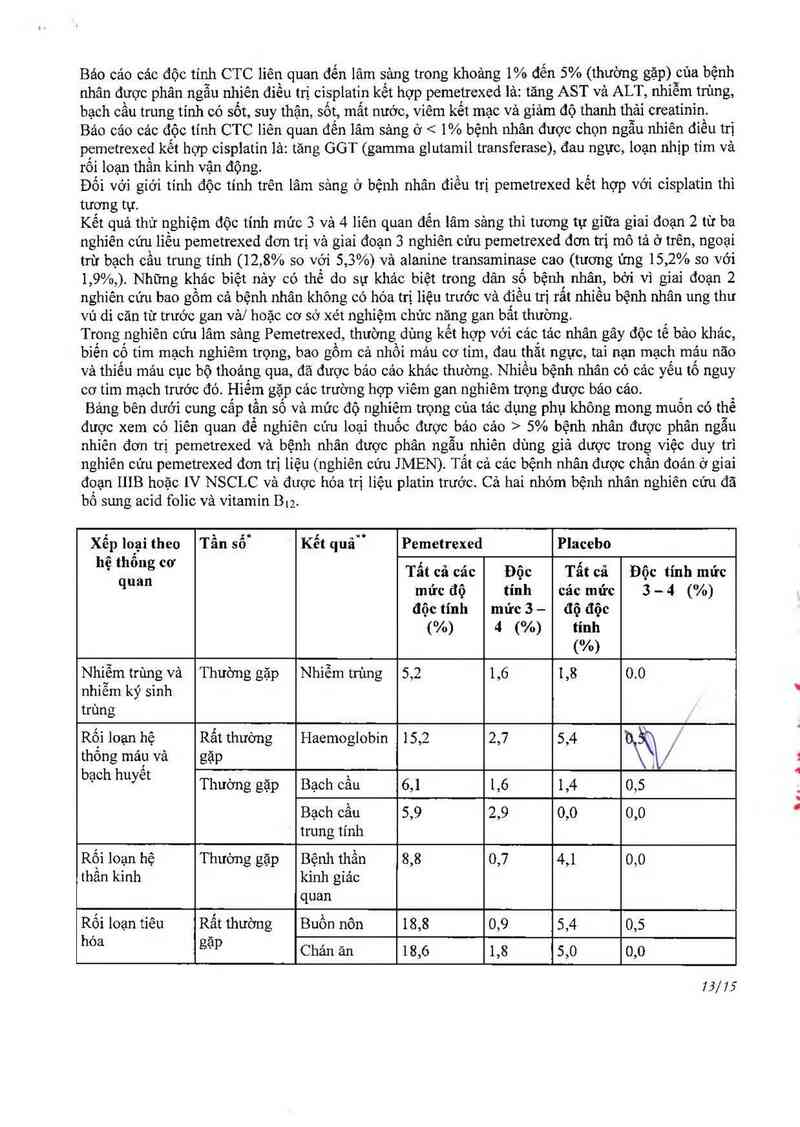
Bảng bên dưới cung cắp tần sô và mức độ nghiêm trợng của tác dụng phụ không mong muốn có thể
được xem có liên quan để nghiên cún loại thuốc được bảo cảo > 5% bệnh nhân được phân ngẫu
nhỉên đơn trị pemetrexed và bệnh nhân được phân ngẫu nhiên dùng giả dược trong việc duy trì
nghỉên cứu pemetrexed đơn trị líệu (nghiên cứu JMEN). Tất cả cảc bệnh nhân được chấn đoản ở giai
đoạn IIIB hoặc IV NSCLC vả được hóa trị liệu platin trước. Cả hai nhóm bệnh nhân nghiên cứu đã
bổ sung acid folic vả vitamin B12.
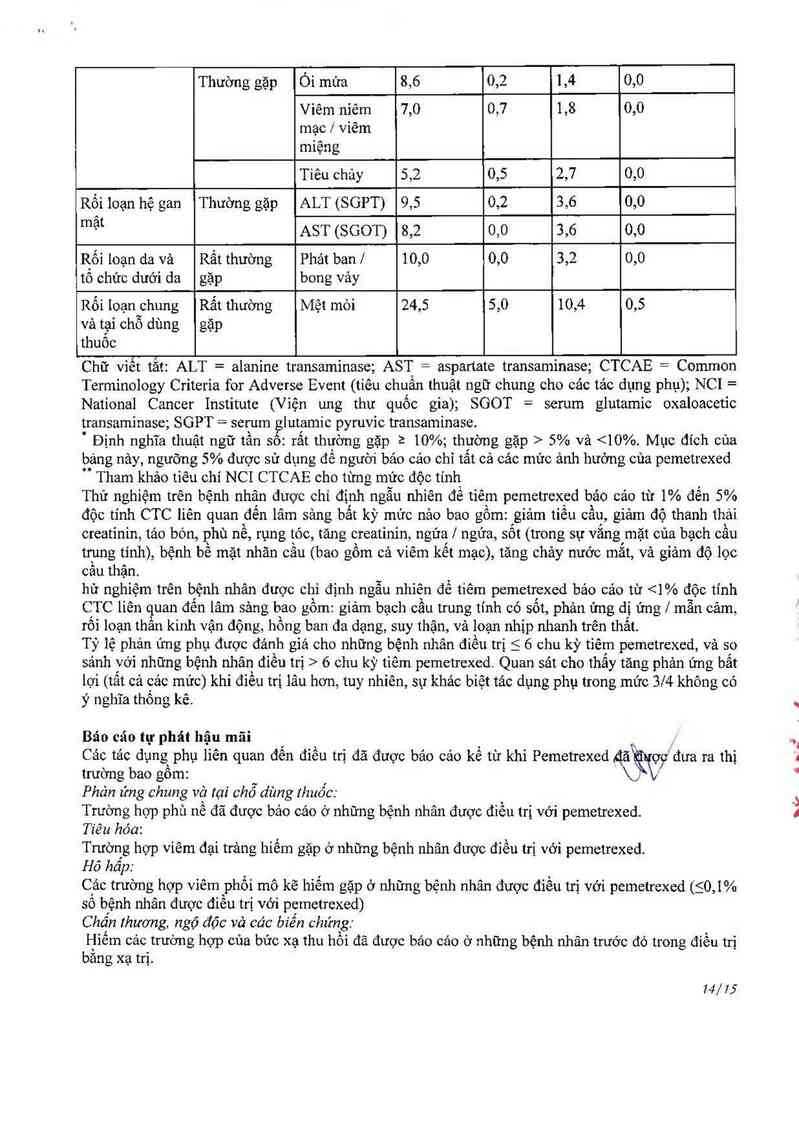
Xếp logỉ theo Tần sổù Kết quảM Pemetrexed Placebo
hẹ thị’ẫ'ngcơ Tất cả các Độc Tấtcả Độc tính mửc
“' mức độ tỉnh cảc mửc 3 - 4 (%)
độc tính mửc 3 — độ độc
(%) 4 (%) tinh
(%)
Nhiễm trùng và Thường gặp Nhiễm trùng 5,2 1,6 1,8 0.0
nhiễm kỷ sình
trùng
Rội loạn hệ Rất thường Haemoglobin 15,2 2,7 5,4 "
thông mảư vả gặp 1 /
bạch huyet Thường gặp Bạch cầu 6,1 1,6 1,4 0,5
Bạch cầu 5,9 2,9 0,0 0,0
trung tính
Rội loạn hệ Thường gặp Bệnh thần 8,8 0,7 4,1 0,0
thân kinh kinh giảc
quan
Rối loạn tiêu Rất thường Buồn nôn 18,8 0,9 5,4 0,5
hoa gạp Chản ăn 18,6 1,8 5,0 0,0
13/75
Thường gặp Ói mừa 8,6 0,2 1,4 0,0
Viêm niêm 7,0 0,7 1,8 0,0
mạc / viêm
miệng
Tiêu chảy 5,2 0,5 2,7 0,0
Rối loạn hệ gan Thường gặp ALT (SGPT) 9,5 0,2 3,6 0,0
mạt AST (SGOT) 8,2 0,0 3,6 0,0
R_ối loạn da và Rất thường Phảt ban/ 10,0 0,0 3,2 0,0
tô chức dưới da gặp bong vảy
Rối 1oạnghung Rất thường Mệt mỏi 24,5 5,0 10,4 0,5
vả tại chõ dùng gặp
thuôc
Chữ viễt tắt: ALT = alanỉne transaminase; AST = aSpartate transaminase; CTCAE = Common
Terminology Criteria for Adversc Event (tiêu chuẩn thưật ngữ chung cho cảc tảo dụng phụ); NCI =
National Cancer Institute (Viện ung thư quốc gia); SGOT = serum glutamic oxaloacetic
transaminase; SGPT = serum glutamic pyruvic transaminase.
Định nghĩa thuật ngữ tần sô: rất thường gặpầ 10%; thường gặp > 5% và <10%. Mục đích của
bảng nảy, ngưỡng 5% được sử dụng để người bảo các chỉ tất cả các mức ảnh hưởng của pemetrexed
Tham khảo tiêu chí NCI CTCAE cho từng mức độc tính
Thử nghiệm trên bệnh nhân được chỉ định ngẫu nhỉên để tiêm pemetrexed bảo cảo từ 1% đến 5%
độc tính CTC liên quan đến lâm sảng bất kỳ mức nảo bao gồm: giảm tiểu cầu, giảm dộ thanh thái
creatinin, tảo bón, phù nề, rụng tóc, tăng creatinin, ngứa / ngứa, sốt (trong sự vẳng mặt của bạch cầu
trung tính), bệnh bề mặt nhãn cầu (bao gồm cả viêm kết mạc), tăng chảy nước mắt, vả giảm độ lọc
câu thận.
hử nghiệm trên bệnh nhân được chỉ định ngẫu nhiên để tiêm pcmetrexcd báo cảo từ 6 chu kỳ tỉêm pcmetrexed. Quan sảt cho thấy tăng phản ứng bất
lợi (tất cả cảc mức) khi điều trị lâu hơn, tuy nhiên, sự khác biệt tác dụng phụ trong mức 3/4 không có
ý nghĩa thống kê
Báo các tự phát hậu mãi
Cảo tác dụng phụ liên quan đến điều trị đã được báo cáo kế từ khi Pemetrexed đã ẵượơ đưa ra thị
trường bao gôm:
Phản ứng chung vả tại chỗ dùng thuốc
Trường hợp phù nổ đã được bảo cáo ở nhũng bệnh nhân được đìếu trị vởi pemetrexed.
Tiêu hỏa:
Trường hợp viêm đại trảng hiếm gặp ở những bệnh nhân được điều trị vởi pemetrexed.
Hô hảp:
Cảo trường hợp vìêrn phổi mô kẽ hìếm gặp ở nhũng bệnh nhân được điều trị vởi pemetrexed (<0, 1%
số bệnh nhân được điếu trị vởi pemetrexed)
Chấn thương, ngộ độc vả các biến chứng
Hìếm cảc trường hợp của bức xạ thu hồi đã được bảo cảo ở những bệnh nhân trưởo đó trong điều trị
bằng xạ trị
14/75
Da
Tình trạng bóng nước toảní thân đã được bảo cảo bao gồm hội chứng Stevens-Johnson vả hoại tử
biếu bì độc, mà trong một số trường hợp đã tử vong.
Thông báo cho bác sz những tác dụng không mong muốn gặp phải khi dùng thuốc
QUÁ LIÊU VÀ CÁCH XỬ TRÍ:
Đã có vải trường hợp Pemetrexed quá liều Các trường hợp ngộ độc báo cảo bao gồm giảm bạch cầu,
thiểu máu, giảm tiếu cấu, viêm niêm mạc và phảt ban
Các biến chứng của quá liều bao ồm ức chế tủy xương với biểu hiện giảm bạch cầu, giảm tiếu cẩu
và thiếu mảu. Bên cạnh đó, có thẻ thấy nhiễm trùng có hoặc không có sốt, tiêu chảy và viêm niêm
mạc. Nếu quá liều xảy ra, bác sĩ điều trị thực hiện biện phảp hỗ trợ chung khi cân thiết. Dùng quá
liều pemetrexed bao gồm sử dụng cảc leucovorin vả thymidine. Việc sử dụng calci folinatl acid
folinic cũng có thế được xem xét trong việc dùng Pemetrexed quá liều.
Trong cảc thử nghiệm lâm sảng, dùng leucovorin cho phép CTC mức 4 giảm bạch cầu kéo dải > 3
ngây, và ngay lập tức CTC mức 4 giảm tiếu cầu, mức 3 giảm tiểu cầu liên quan đến chảy mảư hoặc
viêm niêm mạc mức 3 hoặc 4. Cảc liều tiêm tĩnh mạch sau 2đảy và lịch trình dùn thuốc của
leucovorin được khuyến cáo sử dụng tiêm tĩnh mạch: 100 mg/mz, tiêm tĩnh mạch một lân, tiếp theo
là leucovorin, 50 mg/mz, tiêm tĩnh mạch mỗi 6 giờ trong 8 ngảy.
Khả năng của Pemetrexed bị thẩm tảch lá không rõ.
BẢO QUÁN: Bảo quản nơi khô, dưới 30°C.
Pemetrexed được ón đinh trong vòng 48 giờ sau khi pha và pha loãng dung dịchỞ iêm natri cloric
0 ,9%, để ở nhiệt độ 2- 8 °C. ĐỂ THUỐC TRANHXA TẦM TAY TRE EM
HẠN DÙNG: 24 tháng kế từ ngảy sản xuất.
Không dùng thuốc quá hạn cho phép.
TIÊU CHUẨN: Nhã sản xuất
Tên & địa chỉ Nhà sản xuất:
GLENMARK GENERICS S.A.
Calle 9 Ing. Meyer Oks N° 593, Parque Industrial Pilar
Provincia de Buenos Aircs, Argentina
TUQ CỤC TRUỞNG
P.TRUỞNG PHÒNG
eẢgaấẻn lẫg fflìnỵ
15/75
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng