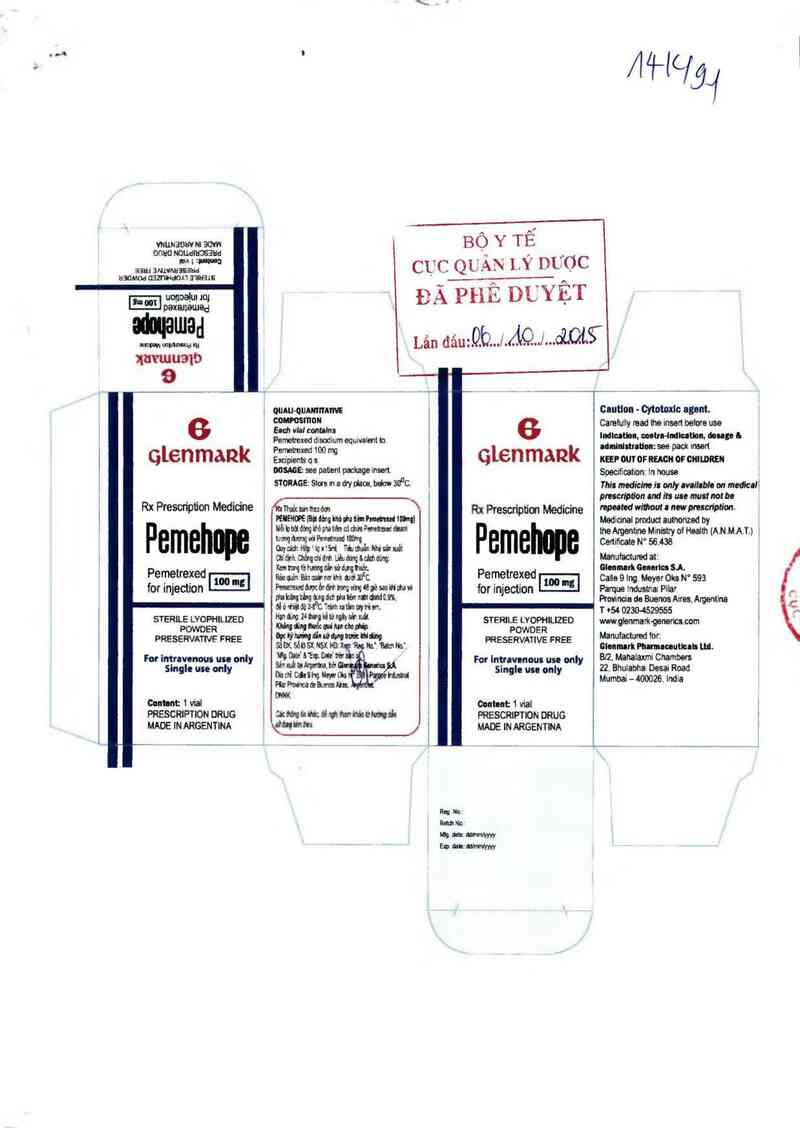










vvuuaovv M …
onuo mu…
… i =…
333ả 3NlVANÌSEHd
HỦMOd naanaon ắWẵLS
uonoeiu mi
nm paxewued
W…ãd
mm un… m
nnvmuenb
Ang,
CỤC QUẢN LÝ mfợc
ĐÀPHỂ
BỘYTẾ
DỦỸỆT
Lân đâuz.Qb…J/.i …J…dÌQLỂ
qtenmank
Rx Prescription Medicine
Pemehope
Ệĩ'ẵảỉể'ẵỉẫẵ-
STERiLE LYOPHILIZED
POWDER
i
1
PRỂSERVATNE FREE
For ìntrnvonous uu only
Single use only
mmt: 1 viat
PRESCRIPTION DRUG
MADE tN ARGENTINA
, OUALI-QUAII'IIỈAI'IE
c…smmi
Endt vhl ccnttlns
Permtfexed disođium equivalent tn
Pemetĩexed 100 mg
Excỉpỉants q s
MSAGE see patient pncitage mm
srouce: Stơu m a div ntm. below au°c.
'Ếihớmncoim \
vtvtuưenatmlmtiin'intmvuitinigi
IiờhhđđờigthỏtiủtbtniủinFmeùưffl
iiivgomqmpmuuiiim
Oiytz'diHh tu 51 TủidiuiuMcs’oiuẩt
cmn.ctớựnm Liè.đhql_idMìm
Ienmtùhmủnidưnnk.
ủmảnũttmmlhuùmmnc.
Ptmuetitructnùnmẹtớqapmiiiwvi
ơeltatrbgớvigớớuuiớtinmtin,
diỉiHũH°tlĩffluthưựin
iimớimzimuimiisinmit
Mi_ủìnt ỨMGMM
ẫdy ty“…ìgdmmmwm
ncsinsxusxvnmmưuam
ưgoiiaifớoưiừm
Siinmấlukựlưhờũm
ủth'ClúitIgtiựũn Haiti
PIuPtuừmừủmtnủ
niut
ct:mumatmmnbumủ
Ỉ qmum
€!
qtenmank
Rx Prescriptim Medicine
Pemehope
Pemetrexed
for injection
STERILE LYOPHILIZED
POWDER
PRESERVATIVE FREE
For intnvenout use only
Singh uu only
Onlhttti via!
PRESCRIPTION DRUG
MADE IN ARGENTNA
Rll'b`
%…
Wth
EIIÙIWMWM
Cautlon - Wtotoxlc agont.
Carequy mad the insert beiore use
Iođlcnunn. colenđtcctbn, douu &
umimm: see pack meett
KE! otnochtt OF cmmtat
Specifitztm: ln house
Thì: modicỉneis twưywoltnblo nnmedcolí
pmcưpơon and Its use must not be
mpnmd tvitliout c … pmscdptim.
Moduc'nat prottuơ luthorized by
the Aigentne Ministry of Hedth (A.NMAT.) {
Ceitiũcate N° 56.438
Manubctutsd at:
ũIlniuú Guutu S.A.
Cale 9 Ing. Meyer Ottn N“ 593
Pnrque lndusữiai Pihr
vaincin do Buenos Am. Aigentlna
T ơ54 02304529555
www.gtenmamgmmmnwm
Manutactured inr.
Blcttlurk Flilmnmttclh Lu.
812. Mahalaxmỉ Cham…
22, Bhulabha Desa Road
Mumbai - 400026, India
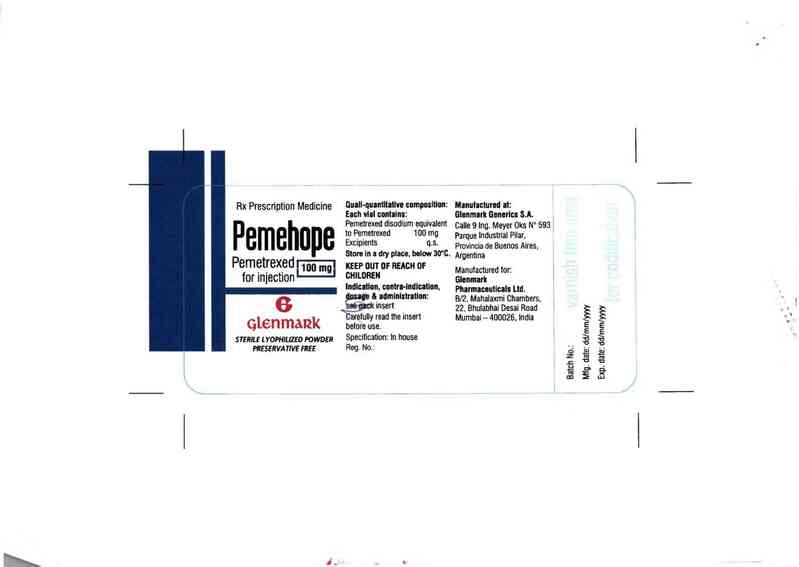
Rx Prescription Medicine
Pemehupe
Pemetrexed 100 mg
ior injection
6
qtenmatzk
STERILE L YOPHILũED POWDER
PRESERVATIVE FREE
0uall-quantttattvn compostttnn:
Each vtnl contalns:
Pemetrexed disodium equivalent
to Pemetrexed 100 mg
Excipients q.s.
Store In a dry place. below 30'0.
KEEP OUT OF REACH OF
GHILDREN
Indlcation. cnntta-Indlcatìon.
` & ađmlntstration:
insert
Cưetulty read the insert
betore use.
Specitìcation: ln house
Reg. No.:
Manutactumt at:
Glcnmarlt Benevlcs S.A.
Calle 9 Ing. Meyer Oks N° 593
Parque lndustrtal Pilar.
Provincia de Buenos Aires.
Argentina
Manưtactured tor.
Glonmuk
Pharmaccutlcals Ltd.
Bl2. Mahalaxmi Chambers.
22. Bhulabhai Desai Road
Mumbai — 400026. India
Batch No.:
Mig. date: ddlmmlyyyy
Exp. date: dd/mm/yyyy
HƯỚNG DẨN sử DỤNG / _ ,
Rx , , , _ vỉ… PHề Nn: ẩ\a_J ụ_
Thuoc nảy chỉ~ban theo đơn cua bảc sy l' ,-f DM Di ²í Ề
' ’ Đọc kỹ hướng dân sưdụng trước khi dùng ẻÂ Ttbt11',viỉ’Nin_` .
Muôn biêt thếm thông tin chi tiêt xin hỏi Bác sỹ hoặc Dược " HỔ C… MiNulý
f,;f'* ,r
PEMEHOPE 100
(Bột đông khô pha tiếm Pemetrexed 100 mg)
THÀNHIPHÀN: Mỗi lọ thuốc bột đông khô pha tiêm có chứa:
Hoạt chảt: Pemetrexed dinatri tương đương với Pcmetrexed ................... 100 mg
Tá dược: Mannitol, Natri hydroxid hoặc Acid Hydroclorid.
DẠNG BÀO CHẾ: Bột đông khô pha dung dịch tiêm truyền.
QUY CÁCH ĐÓNG GÓI: Hộp 1 iọ x lSml
DƯỢC LỰC HỌC:
Pcmetrexed iả một chất antifolat chứa nhân pyrroiopyrimidin- dựa trên những tảc động của chất chống
ung thư bằng cách lảm gìán đoạn quá trình trao đối chẳt folatc phụ thuộc cân thiết cho tải tạo tế bảo.
Trong nghiên cứu invitro pemetrexed ức chế thymidylate synthase (TS), dihydrofolate reductase (DHFR)
vả glycinamide ribonucieotide formyltransferase (GARFT), tắt cả cảc enzym phụ thuộc folat liên quan
đến sinh tổng hợp novo của thymidin vả purin nucleotide. Pemctrcxcd được vận chuyến vảo trong tế bảo
bằng chất mang folat giống như những hệ thống vận chuyền protein có gắn kểt với folat mảng. Khi vảo
trong tế bảo, pcmctrexed được chuyền đối sang dạng polyglutamat bởi enzym folylpolyglutamate
synthetasc. Cảo dạng polyglutamat dược giữ lại trong tế bâo như là những chất ức chế TS vả GARFT.
Quá trình polyglutamat lả một quá trình phụ thuộc thời gian và nồng độ xảy ra ở những tế bảo u vả, đến
mức thấp hơn trong mô binh thường. Chât chuyến hóa polygiutamat có thời gian bản hùy nội bảo dải dẫn
đến gia tăng thời gian tảc dụng cùa thuốc trong cảc tế bảo ảc tính.
Những nghiên cứu tiền lâm sâng cho thắy rằng Pcmetrcxed ức chế sự phát triển dòng tế bảo
mesothelioma trên in vitro (MSTO- 2] lH, NCL- -.H2052) Những nghiên cứu với dòng tế bảo MSTO-
21 IH mesothelioma cho thấy tác động hiệp dồng khi pcmctrexed kết hợp đồng thời với cisplatin.
Số lượng bạch cầu trung tính (Absolute neutrophil counts) NC) sau khi sử dụng pemetrexed như lá
thuốc đơn độc cho những bệnh nhân không bổ sung acid folicxắ Ềgamin được đặc trưng sử dụng những
phân tích dược động học dân số. Mức độ độc tính huyết họỄ Ềẩc quyết định bởi độ điếm thấp nhất
ANC, tỉ lệ nghịch với diện tích dưới dường cong cùa Pcmetrcxed. Người ta cũng quan sảt những bệnh
nhân có nồng độ cystathionine hay homocysteine cơ bản cao có ANC thấp hơn. Mức độ các chất nảy có
thế dược giảm xuống bởi cung câp folic acid vả vitamin B12. Không có ảnh hưởng lũy tich đến diện tích
dưới đường cong của pemetrexed trên ANC thấp nhất được quan sát trên nhiều đợt điểu trị.
Sau khi tiêm pemetrexed, thời ian đế ANC đạt mức thấp nhất dao động từ 8- 9, 6 ngảy với liều 38, 3-
316,8 mg giờ / mL. ANC trờ ve ban đầu khoảng 4, 2- 7, 5 ngảy sau tính từ thời điểm ANC thấp nhất.
DƯỢC ĐỘNG HỌC
Dược dộng học cùa đơn trị liệu pcmetrcxed với liều từ 0, 2 to 838 mg/m2 truyền tĩnh mạch trên 10 phút
được khảo sát ở những bệnh nhân bệnh ung thư có những khối u đặc khảc nhau. Pemetrcxcd không được
chuyền hóa trong phạm vi rộng và được đảo thái chủ yêu trong nước tiếu, với 70% đển 90% liếu được
hồi phục không đối trong 24h đầu sau khi sử dụng. Độ thanh thải hệ thống của pemetrexed là 91,8
mL/phủt và thời gian bán hùy của pemetrexed là 3 5 giờ ở những bệnh nhân có chức năng thận bình
thường (độ thanh thải creatinine 90 mLf phút). Khi chức năng thận giảm (độ thanh thải gỉảm), diện tích
dưới đường cong (AUC) tăng. Diện tích dưới đường cong pemetrexed (AUC) và nồng độ huyết tương tối
đa (Cmax) tăng tỉ lệ với lỉều. Dược động học của pemetrexed không thay đối trên những chu kỳ (đợt)
điều trị. Pemetrexed có thể tích phân phối hằng định là 16,1L. Trong những nghiên cứu in vỉtro cho thắy
rằng pcmetrexed liến kết vởỉ proteỉns huyết tương khoảng 81%. Sự liên kết nảy không bị ảnh hưởng mức
độ suy thận.
Dược động học cùa pemetrexed trong nhũng đối tượng đặc biệt đã được kiếm tra vởỉ cảc bệnh nhân
trong một nghìên cứu đơn có mục đích và có kìểm soát
Bệnh nhản lởn tuổi , _
Không thấy ảnh hưởng của tuổi tảc trên dược động học của pcmetrexcd trong 26 đên so tuôi.
Trẻ em
Những bệnh nhân nhi không được khảo sảt trong những nghỉên cứu lâm sảng.
Giởi tính
Dược động học cùa pcmetrcxed không khảc biệt giữa nam và nữ.
Chủng tộc
Dược động hỌG của pemetrexed Ở những bệnh nhân da trắng tương tự những bệnh nhân người gốc Phi.
Không có những dữ liệu có giá trị dầy đủ khi so sảnh dược động học cùa những nhóm chùng tộc còn lại.
Ở những bệnh nhân suy gan— Không ghi nhận tăng AST (SGOT), ALT (SGPT) hay bỉiirubin toản phần
trên dược động học của pemetrexed Tuy nhiên, những nghiên cứu trên bệnh nhãn suy gan không được
kíếm soát, như những bệnh nhân có bỉlirubìn >1,5 lần gỉới hạn trên của bình thường hoặc những bệnh
nhân có transaminase > 3,0 lần giởi hạn trên của binh thường, hoặc cả 2 nhóm bệnh nhân nảy nhưng
không có bầng chửng di căn gan, hoặc những bệnh nhân có transaminase > 5,0 lẳn giới hạn trên cùa bỉnh
thường và di căn gan.
Những bệnh nhân suy thặn
Những phân tich dược động học được khảo sát trên những bệnh nhân có suy thận. Độ thanh thải huyết
tương của pemetrexed giảm khi có mặt cìsplatin khi chức năng thận gỉám, vởi sự gìa tăng diện tích dưới
đường cong. Những bệnh nhân có độ thanh thải creatinine là 45, 50 và 80 mL/phủt có sự gia tăng tương
ứng 65%, 54% và 13% toản bộ diện tích dưới đường cong (AUC) với độ thanh thải creatinine là 100
mL/phút.
CHỈ ĐỊNH ĐIỀU TRỊz
Ung thư phổi loại tế bản lớn (không nhỏ) không phải tế bảo vảy (không vảy) - kết hợp với
Cisplatin
Pemetrexed được chỉ định kết hợp vởỉ cisplatỉn trong đỉều trị khởi đằu ửng bệnh nhân ung thư phối
loại tế bảo lởn (không nhò) không phải tế bảo vảy tăng sinh tại chỗ hoặc'h ịcăn.
Ung thư phổi loại tế bản lớn (không nhỏ) không phải tế bảo vảy— Duy trì
Pemetrexed được chỉ định trong điếu trị đuy trì những bệnh nhân ung thư phổi loại tế bảo lớn (không
nhò) không phải tế bảo vảy có tăng sinh tại chỗ hoặc có di căn mả bệnh không tiến triển sau 4 chu kỳ
platin- dựa trên hóa trị lỉệu bưởc đầu.
Ung thư phổi loại tế bâo ión (không nhỏ) không phải tế hảo vảy Sau hỏa trị liệu trựởc đỏ
Pcmetrexed được chỉ định như lá thuốc đơn để điêu trị cho những bệnh nhân ung thư phối loại tế bâo lớn
(không nhỏ) không phải tế bảo vảy tăng sinh tại chỗ hoặc có di căn sau đọt hóa trị liệu trước đó.
U trung biễu mô
Pcmctrexcd kết hợp với cispiatin được chỉ định trong đíếu trị những bệnh nhân bị u trung biền mô phổi
ác tính là bệnh không thể được điếu trị bằng phẫu thuật cắt bỏ.
Giới hạn sử dụng
Pemetrexcd không được chỉ định cho điều trị những bệnh nhân ung thư phổi loại tế bảo lởn (không nhò)
tế bảo vảy.
LIÊU LƯỢNG VÀ CÁCH SỬ DỤNG:
Pemetrexed chí được đùng để tiêm tĩnh mạch `
Pemetrexed phải được sử dụng dưới dưới sự kiêm soát chặt chẽ cũa bác sỹ có kinh nghiệm trong việc sử
dụng những thuốc chống tăng sinh.
Sử dung kết hơp với Cỉsnlatin:
Liều Pcmetrcxcd được khuyến cáo lả 500 mg/m2 cho qua đường truyền tĩnh mạch trên 10 phút vảo ngây
thứ nhẩt cùa mỗi chu kỳ 21 ngảy. Liều khuyến cáo của ciSplatin là 75 mg/m2 cho qua đường truyền tĩnh
mạch trên 2 giờ, được bắt đầu khoảng 30 phút sau khi kết thúc truyền Pemctrexed, vảo ngảy đầu tiên cùa
mỗi chu kỳ 21 ngảy. Những bệnh nhân nây nên được điều trị thuốc chống ỏi vả bù nước thích hợp sau
khi vảÍ hoặc truớc khi dùng cisplatin.
Svữ dung đơn tri lỉêu: _ ` .
0 những bệnh nhân ung thư phôi đã có hóa trị liệu trước, liêu khuyên cảo của Pcmctrcxed lả 500 mg/m2
truyẽn tĩnh mạch trên 10 phút trong ngảy thứ nhât của mỗi chu kỳ 21 ngây.
Cảc thuốc chuẩn bi chế đó điều tri:
Corticostert'od `
Đò da được bảo cáo thường gặp trên những bệnh nhân không được điêu trị bằng corticosteroid trưởo đây.
Việc điểu trị trưởo bằng dexamcthasonc (hoặc tương đương) lảm giảm ti iệ và mức độ phản ứng da.
Trong những nghỉên cứu lâm sảng, cho 4 mg dexamethasone bằng đường uống 2 lần một ngảy vảo cảc
ngảy trưởo, ngảy dùng thuốc và 1 ngảy sau khi dùng Pcmetrcxed.
Bổ sung Vitamin
Đề gỉảm độc tính cho những bệnh nhân đang điều trị với Pemctrcxcd nên cho một liệu thẳp bằng đường
uống gồm acid folic hoặc hỗn hợp vitamin có acid folic Trong suốt 7 ngảy trước lỉẽu đầu Pcrnctrexcd,
nên cho ít nhất 5 liếu acid folic; và uống tiếp tục đẩy đủ trong chu kỳ dùng thuốc và 21 ngảy sau khi tiêm
liều Pemetrexed cuối cùng Tiêm bắp ] lỉều vitamin Biz trong tuần dùng liều Pcmetrexed đầu tỉên và
trong 3 chu kỳ tiếp theo. Nhũng lần tiêm vitamin 812 sau có thế dược cho ùng ngảy dùng Pemetrexeđ.
Trong những nghỉên cứu lâm sảng, liều acid folic nghiên cưu từ 350 đên l 0 ị.tg, vả liếu vỉtamin Bu là
1000 ụg. Hầu hết lỉều acid folic đường uống sử dụng trong nghiên cứu lâm ng lả 400 ụg.
Những khuvến cảo cho theo dõi thử nghiêm và eiãm liều
Theo dõi Đểm số lượng tể bâo máu toản bộ, bao gồm đếm tiếu cầu, phải được thực hìện ở mọi bệnh
nhân sử dụng Pemetrcxed. Bệnh nhân phải được theo dõi đỉếm thấp nhât và sự hồi phục, được đánh giá
trong nghỉên cứu lâm sảng trước mỗi lìêu vả vảo ngảy 8 vả 15 cùa mỗi chu kỳ. bệnh nhân không phải bắt
đầu một chu kỳ đíều trị mới trừ khi số lượng neutrophil 21,500 tế bảolmm3, tỉếu cầu đếm lả z100,000 tể
bảo/mm3, và độ thanh thải creatinine 245 mL/phút. Những test hóa mảu phải được thực hìện định kỳ để
đảnh giá chức năng gan và thận. `
Bilỉrubin toản phân phải 51.5 lân gỉới hạn trên bình thường. Alkalỉnc phosphatase (ALP), aSpartate
transaminase (AST or SGOT) vả alaninc transaminase (ALT or SGPT) phải 53 iân gjớì hạn trên bình
thường. Alkaline phosphatase, AST, vả ALT 55 iân giởi hạn trên binh thường lá có thế châp nhận được
nêu như có ảnh hưởng giả u trên gan.
n
Ul ln'
i…~ …
Những khuyến cáo giám liều— Điếu chinh lìều vảo đầu chu kỳ tỉếp theo phải căn cứ vảo con số thấp nhất
của sô lượng tế bảo máu của chu kỳ điếu trị trước đó. Điều trị có thế bị trì hoãn để có đủ thời gỉan phục
hồi. Khỉ phục hồi, bệnh nhân nến được điếu trị iại sử dụng các khuyến cảo trong bảng dưới đây, được ảp
dụng cho Pemctrexed dơn trị hoặc kểt hợp vởi Cỉsplatin.
Bãng: Gỉãm liều điều trị Pemetrexed (trong đơn trị liệu hoặc kểt hợp) và Cisplatin - Độc tinh huyết
hợc
số lượng bạch cầu trung tính thấp nhẳt 50,000ln1m3 ` '
Số lượng tiểu câu thấp nhất <50, OOOÍmm bẩt kể số Iượng 75% lìêu trước đó (cả 2 thuôo)
bạch câu trung tính thẫp nhắt là bao nhiếu
Số lượng tiếu cầu thẩp nhất <50. (JOO/mm3 kèm theo xuất 50% liêu trước đó (Cả 2 thUỔC)
huyễt, bất kể số lượng bạch cẳu trung tính thấp nhẫt là
bao nhiêu
Nếu bệnh nhân có dâu híệu nhiếm độc không phải bệnh lý huyết học (ngoại trừ độc thẩn kỉnh)_ > mức 3,
Pemetrexed phải được ngưng cho đến khi mức độ nhiếm độc thấp hơn hoặc bằng mức độ trưởo khi đỉều
trị. Điếu trị phải được tiêp tục theo hưởng dẫn trong bảng dưới đây.
Bảng: Giảm liều điều trị Pemetrexed (trong đơn trị liệu hoặc kết hợp) và Cisplatin - Độc tính huyết
họcas b
Liều Pemetrexed (melmz) Liều Cisplatino (mglm2)
Bếtk`đ^ t'h '3h"4 ..; , , .; , ,
a .y ,ọc.. … .Ễnưc oạc ’ 75% lieu trươc đo 75% lieu trươc đo
ngoại trư v1cm niem mạc
BâỈ kỳ tíêu chảy cần nhập viện ,, .t . , ,, .2. . .
hoặc mức 3 hoặc 4 75 Ái hcu trươc đo 75 A› l1cu trươc đo
Viêm nỉêm mạc mức 3 hay 4 50% lỉêu trưởo đó IOO% liễu trước đó
² NCI Common Toxícìty Crỉterỉa (CTC): Tiêu chuẩn độc tính chung
b Excludìng neurotoxicity: Không gồm độc thẳn kinh
Trong trường hợp bị ngộ độc thần kinh, liếu thuốc được khuyến cáo cho Pemetrexeđ vả Cisplatin được
mô tả trong bảng bến đưới. Bệnh nhân phải ngừng điều trị nêu xảy ra nhiềm độc thần kinh ở mửc 3 hoặc
4.
Bảng: Giảm liểu điểu trị Pemetrexed (trong đơn trị liệu hoặc kết hợp) và Ồèblatin- Độc tính thần
kinh
f
Mức CTC Liền Pemetrexed (mg/m2) Liệu Cisplatino (mglm²)
0-1 i00% iiệu trước đó 100% liêu trước đó
2 100% liếu trưởo đó 5 0% liều trước đó
Điều trị Pemetrexed nến ngưng nếu bệnh nhân có bất kỳ dấu hiệu độc tính nảo líên quan bệnh lý huyết
học hoặc không thuộc bệnh lý huyết học mủc 3 hoặc 4 sau 2 lằn giảm liễu, hoặc phải ngưng ngay lặp tức
nếu thẩy dấu hỉệu độc thần kinh mức 3 hoặc 4
Bệnh nhân lớn tuốt“
Ngoài những khuyến cáo gìảm tiếu cho tất cả cảc bệnh nhân ở trên, không cần giảm liều cho bệnh nhân >
65 tuồi.
. [
\O. \ ` _Vn
Trẻ em vả thanh thiểu m'ẻn
Pemetrexed không được khuyến cáo sử dụng ở nhũng bệnh nhân dưới 18 tuổi vì sự an toản vả hìệu quả
cùa Pemetrexed đã không có kết quả ở nhóm bệnh nhân nảy.
Bời vì số lượng bệnh nhân có độ thanh thải creatinin dưới 45 ml / phút thì thẫp, nó không phải lá có thể
đưa ra khuyến cáo lỉều lượng cho nhóm bệnh nhân nảy Do đó, Pcmetrexed không nên đùng cho bệnh
nhân có độ thanh thải creatinin lả <45 ml / phủt bằng cách sử dụng công thức Cockcroft vả Gault (bên
đưới) hoặc GRF được tính bời phương phảp thanh thải huyết tương Tc99m- DPTA:
Nam : [140 —tuồi1 x trong lương cơ thể íKgì = mL/phút
72 x creatinine huyêt thanh (mg/dL)
Nữ: được tính theo công thức độ thanh thải creatinine cho nam x 0.85.
Cẩn thận trọng khi dùng Pemetrexed đồng thời vởi NSAID cho bệnh nhân có độ thanh thải creatinin lả
<80 ml l phứt
Trên những bệnh nhân bị suy gan- -Pemetrexed không chuyền hóa rộng rãi ở gan. Bảng 4 cung cẩp bảng
điều chỉnh liều dựa trên mức độ suy gan trong quá trình điều trị với Pemetrexed.
CÁCH DÙNG:
Chuẩn bi và t__hân tron_z_ khi sử dung
Cũng như những thuốc chống ung thư có khả năng gây độc hại khác, cần thận trọng khi xử lý và chuẩn bị
các dung dịch truyền Pemetrexed Khuyến khích vỉệc sử dụng găng tay Nếu dung dịch Pemetrexed tiếp
xúc với da, rửa sạch bằng nước và xả phòng ngay lập tức. Nếu Pemctrexed tiếp xúc với mảng nhầy, rứa
kỹ bằng nước. Một vải hướng dẫn để xử lý và loại bỏ thuốc chống ung thư đã được công bố.
Pemetrexed không phải lả một thuốc lảm phồng da. Không có thuốc gìảỉ độc đặc hiệu cho tinh trạng
thoảt mạch cùa Pemetrexed Cho đến nay, rất ít trường hợp thoảt mạch của Pemetrexed đă được báo cáo,
tình trạng mả chưa được các đỉều tra viên coi lả nghiêm trọng. Tình trạng thoảt mạch cua Pemetrexed
không nên kiếm soát bới cảc tỉêu chuẩn thực hảnh cơ sở sử dụng với thuốc gây phồng da khác
ử_ẫn bi cllo tiêm truvền tĩnh mạc_h
1. Sử dụng kỹ thuật vô trùng trong quá trình hoản nguyên vả pha loãng Pemetrexed đế tiêm truyền tĩnh
mach.
2. Tính toản liều lượng và số lượng lọ Pcmetrcxed cần thiết. Mỗi lọ Pemetrexed chứa một lượng dư nhỏ
so với lượng trên nhãn để tạo thuận lợi cho việc sử dụng.
3. Hoản nguyên lọ 500 mg với 20 ml dung dịch natri clorid 0, 9% pha tiêm và lo ]00 mg với khoảng 4,2
ml dung dịch natri clorid 0, 9% pha tiêm (không chất bảo quản) đế có được một dung dịch chứa 2
mglmL Pemetrexed. Lắc nhẹ nhảng mỗi lọ cho đến khi bột tan hoản tqảền Kết quả dược các dụng
dịch trong và có mảu sẳc dao động từ không mảu đến mảu vảng hoặc mầu anh lả mạ mã không ảnh 0
hưởng xâu đến chắt lượng sản phẩm Các dung dịch hoản nguyên cùa Pcihetịpcxed có pH giữa 6, 6 và
7, 8. CÀN PHẢI PHA LOẨNG THÊM. "
4. Thuốc tỉêm phải được kiếm tra bằng mắt cảc tiếu phân và sự đối mảu trước khi dùng. Nếu thắy
tiếu phân trong dung dịch, không sử dụng chế phẩm đó.
5. Một Iượng thích hợp dung dịch hoản nguyên của Pemetrexed phải được pha loãng thêm trong dung
dịch natri clorid 0, 9% pha tiêm (không chắt bảo quản để tồng thế tich dung dịch là 100 ml. Dung
dịch Pemetrexed nảy được sử dụng truyền tĩnh mạch trong 10 phủt
6. Dung dịch pemetexcd hoân nguyên và durig dịch pemetexed tỉêm truyền đã được chứng minh là ổn
định lý hóa lên đến 24 gìờ sau khi hoản nguyên ban đẩu, nếu được bảo quản trong tù iạnh hoặc ở
nhiệt độ phòng dưới 25°C. Khi chuẩn bị theo chỉ dẫn, dung dịch hoản nguyên và dung địch truyền
cùa Pemetrexcd không được chúa chất bảo quản chống nâm mốc. Bò bất kỳ phần nảo không sử
dụng.
`U
Tương kỵ
PEMETRẸXED phải được hoản nguyên và pha loãng chỉ vởi dung dịch natri clorid 0,9% pha tiêm
(không chẳt bảo quản). Pemetrexcd tương thieh với bộ truyền chuẩn polyvinyl clorua (PVC) vả tứỉ đựng
dung dịch truyền tĩnh mạch. Pemctrexed iả chắt không tương thích với chất pha loãng có chứa canxi, bao
gôm dung dịch Lactatcd Ringcr vả Ringcr pha tiêm; do đó, những dung dịch nảy không được sử dụng
Việc dùng đồng thời Pemetrcxed với chất pha loãng khảc chưa được nghiên cứu và do đó không khuyến
cáo sử dụng
CHỐNG CHỈ ĐỊNH:
Không được sử dụng Pcmctrexed trong những trường hợp có tỉền cãn mẫn cảm với Pemctrexed hay bắt
cứ thảnh phần nảo của thuốc.
Không tiếp tục diếu trị bằng Pemetrexed trong thời kỳ cho con bú sữa mẹ
Dùng đồng thời với vaccine sốt vảng da.
CẢNH BÁO:
Phân ửng di ứng ,
Tác dụng trên da. Phát ban đã được báo cáo. Sử dụng trước các thuôo nhóm corticosteroid lâm giảm tỷ lệ
gặp và mức độ nghiêm trọng cùa phản ứng dị ứng.
Giảm chức nãng thân `
Pemctrexeđ được đảo thải chủ yểu qua thận. Không cần đỉếu chinh liêu Iượng ở những bệnh nhân có độ
thanh thải creatinin _>_ 45 ml/phút. Bởi vì số iượng bệnh nhân có độ thanh thải creatinin < 45 mllphút là
không đủ do vậy không thể đưa ra khuyến cáo liều lượng cho nhóm bệnh nhân nảy. Do đó, Pemetrexed
không nên đùng cho bệnh nhân có độ thanh thải creatinin lả < 45 ml f phút.
Ức chế tủv xương
Pemetrcxed có thế ức chế chức năng của tủy xương, với biều hiện giảm bạch cầu, giám tỉếu cầu, thiếu
máu hoặc giảm toản thế huyết cầu; suy tùy thường là độc tính liếu giởi hạn Bệnh nhân cân được theo dõi
suy tùy trong khi điếu trị và không nên dùng Pemetrexed cho đến khi số lượng bạch cầu trung tính
(ANC) trở lại > 1.500 tế bảo | mm3 và tiến câu đếm > 100 000 tế bảo / mm. Gìảm liều cho chu kỳ tiếp
theo được dựa trên điếm thắp nhất ANC, số lượng tiếu cẳu, và độc tính không huyết học tối đa quan sảt
thấy trong các chu kỳ trưởo.
Bổ sung Folate vã Vitamin Bu
Bệnh nhân đìều trị vởỉ Pemetrexed cần được hướng dẫn để dùng acid folic vả vỉtamỉn B,; như một bỉện
pháp dự phòng để gỉảm độc tính liên quan đến huyết học vả GI. Trong giaìt ạn III thử nghiệm lậm
sảng, độc tính tồng thế ít hơn và độc tính huyết học và không huyết học ở mức #4 như giảm bạch cầu,
giảm bạch cầu trung tính có sốt, và nhiễm trùng vởi giảm bạch câu mức 3/4, đặịđựợc báo cảo khi acid
folic vả vitamin B,; được dùng truớc khỉ điếu trị
Phu nữ mang thai
Pemetrexed có thể gây hại thai nhi khi dùng cho phụ nữ mang thai. Pcmetrexed gây ra độc tính và gây
quải thai ở chuột vởi liếu 0,2 mg/kg (0,6 mglm²) hoặc 5 mg/kg (15 mg/m²) khi tỉếm tĩnh mạch vâo ngảy
6 và 15 của thai kỳ. Pemetrcxed gây ra dị tật thai nhi (hóa xương không đầy đủ của xương sến và hộp sọ)
là 0,2 mg/kg (khoảng 17833… liếu cùa con người 1V đề nghị trên cơ sở mglm2). Độc tố được đặc trưng
bởi sự gia tăng trong trường hợp tử vong phôi thai và giảm kích thưởc cùa phôi thai. Không nghiến cứu
Pemetrexed nảo được tiến hảnh trên phụ nữ mang thai. Bệnh nhân nữ được khuyên nên tránh có thai. Phụ
nữ có khả năng sinh đẻ nến sử dụng biện phảp trảnh thai có hiệu quả khi đìếu trị Pcmctrcxcd. Nếu bệnh
lư.t
nhân đỉếu trị Pemetrcxcd trong khi mang thai hoặc dự định có thai, bệnh nhân cần được thông báo về
những môi nguy hiếm tiêm ân cho thai nhỉ.
THẬN TRỌNG
Pemetrexed được sử dụng điếu trị ung thư dưới sự kỉếm soát chặt chẽ cùa bác sĩ có kỉnh nghiệm.
Đếm số lượng tế bảo máu, bao gồm số lượng tìếu cầu nến được thực hiện ở tắt cả cảc bệnh nhân dùng
pemetrexed. Bệnh nhân cần được theo dõi điếm thẳp nhất và sự phục hồi; số lượng tế bảo mảu được theo
dõi trước mỗi iiếu vả vảo ngảy 8 và 15 cùa mỗi chu kỳ đỉếu trị trong cảc nghiên cứu lâm sảng.
Cần được theo dõi định kỳ chức năng thận và gan
Cảc bỉến chứng có thế được kiếm soát một cảch thich hợp chỉ khi cảc phương tỉện chẩn đoán và điều trị
phù hợp vả đầy đù. Cảo tác dụng phụ lỉến quan đến diều trị do Pemetrexed có thể hồi phục trong cảc thử
nghiệm lâm sâng. Phát ban da thường xuyên quan sảt thấy ơ những bệnh nhân không đìếu trị trước vởỉ
corticosteroid. Đỉếu trị trước vởi dexamethasone (hoặc tưong đương) lảm giảm tỷ lệ mắc và mức độ
nghiêm trọng của phản ưng da
Hiệu quả sử dụng Pemetrexed trên bệnh nhãn trản dịch mảng phổi và cổ trướng thì chưa rõ. Ở những
bệnh nhân nảy, việc dẫn lưu dịch trước khi đỉều trị Pemetrexed cân được xem xẻt.
Pcmetrexed có thể gây hại về mặt di truyền. Đản ong trưởng thânh nên trảnh lảm cha trong khi đỉều trị
Pemetrexed vả 6 tháng sau đó. Biện pháp tránh thai hoặc tỉết chế được khuyến khích.
Vì Pemetrexed có thể gây ra vô sinh, nam giới nên tìm lời khuyên từ bảc sĩ được tư vẳn về lưu trữ tinh
trùng trưởo khi bắt đầu đỉếu trị.
Độc tính Pemctrexcd trên tiêu hóa khi dùng kết hợp với cỉsplatin, mắt nước nghìẽm trọng có thể xảy ra.
Vì vậy, bệnh nhân nên được đỉếu trị chống nôn đầy đủ và mât nước thích hợp trưởo vả/ hoặc sau khi
được đỉếu trị.
Gây ung thư, đột bỉến vả ảnh hưởng lrên khả năng sỉnh sân
Không có nghiến cửu nâo vế gây ung thư đã được tiến hânh với pemetrexed. Pemetrexed lả chẳt gây đột
bỉến câu trúc nhiễm sẳc thế trong thủ nghiệm i'n vivo về cấu trúc vì nhân trong tủy xương chuột; tuy
nhiến, nó không gây đột biến trong nhiếu thử nghiệm t’n vitro (Thử nghiệm Ames, CHO). Pemetrexed
tỉêm tĩnh mạch với lỉều 0,1 mg/kg/ngảy hoặc iỉếu cao hơn cho chuột đực (khoảng l/1666 lỉếu khuyến cáo
cho người tính theo mg/m2 ) dẫn đến giảm khả năng sinh sản, giảm khả năng xuất tinh và tco tinh hoản.
Sử dụng pemetrexed cho chuột mang thai đẫn đến giảm trọng lượng thai nhi, ảnh hướng tới quá trinh
hinh thảnh xương không được hoản chỉnh của một số cẩu trúc xương và hờ vòm miệng.
Ảnh hưởng đến khả nãng lái xe vả điều khíễn máy móc ,\
Chưa có nghỉên cứu được tiến hảnh Tuy nhiên, Pemetrexed đã được báo cá y ra mệt mỏi, do đó,
bệnh nhân cân được cảnh bảo để tránh lái xe hay vặn hảnh mảy móc fk '
Dùng cho phụ nữ có thai
Nên tránh sử dụng Pemctrexcd cho cảc phụ nữ có thai do khả năng nguy hiếm cho thai nhỉ. Nghiên cứu
trên động vật thấy có độc tính sinh sản như dị tật bẩm sỉnh vả ảnh hưởng khảo trên sự phát triên thai nhi,
quá trình mang thai hay trước và sau khi sinh.
Phụ nữ cho con bú
Sự tìêt các thảnh phần hoạt tinh vâ/ hoặc cảc chẳt chuyến hóa trong sữa mẹ
Pemetrexed hoặc các chất chuyến hóa được tiết trong sữa mẹ chưa rõ. Bởi vì nhiễu loại thuốc được bải
tiết trong sữa mẹ, và do khả năng cảc phản ứng phụ có hại cùa Pemetrexed cho trẻ sơ sỉnh bú sữa mẹ,
phụ nữ đang cho con bú nên ngừng nếu người mẹ đỉều trị Pemetrexed.
Dùng cho rre’ em
` ` › n › a v … A A v ~ 11 ~ , ~
Sự an toan va hiẹu qua cua Pemetrexed ơ nhưng bẹnh nhan dươi 18 tu… chưa được xac định
Dùng cho nguời cao tuỗi
Điếu chinh liếu dựa vâo độ tuổi khảo hơn so vởi những khuyến cảo cho tất cả các bệnh nhân đã không
được yêu cầu.
Giới tính
Điếu chinh liếu dựa trên giới tính khác hơn so với những khuyến cáo cho tẩt cả cảc bệnh nhân đã không
được yêu cằu.
Vì Pemetrexed có thể gây ra vô sinh không thể thay đối, bệnh nhân nam nên tìm iờì khuyên từ bác sĩ
hoặc dược sĩ thông tin vế lưu trữ tỉnh trùng trưởo khi bắt đầu điếu trị.
Dùng cho bệnh nhân suy gan
Bệnh nhân bilirubin> 1, 5 lân gỉởi hạn trên đã được loại trừ từ cảc thử nghỉệm lâm sảng vởi Pemctrexed.
Bệnh nhân transaminase> 3, 0 lần giới hạn trên mức bình thường đã được loại trừ một cách hệ thống từ
các thử nghiệm lâm sảng nếu không có bằng chứng cùa di cãn gan. Những bệnh nhân có men 3- 5 lần giới
hạn trên mức binh thường bao gõm trong thử nghiệm lâm sảng với Pemetrexcd nếu có di căn gan. Bảng
nảy cho thấy những điếu chinh liếu dựa trên suy gan khi điều trị Pemetrcxed.
Dùng cho bệnh nhãn suy thận
Pemetrexed được thải trừ chủ yếu qua thận. Chức năng thận giảm dẫn đển độ thanh thải vả diện tích dưới
đường cong (AUC) Pemetrexed giảm đối với các bệnh nhân có chức năng thận binh thường Dùng đồng
thời với cisplatin chưa được nghìên cứu ở những bệnh nhân suy thận trung bình.
TƯỚNG TÁC VỚI CÁC THUỐC KHÁC vÀ cAc DẠNG TƯỢNG TÁC
Pemctrexed thải trừ chủ yếu dưới dạng không đối qua thận như một kết quả cùa lọc cầu thận vả bải tiết
ống. Dùng đồng thời các thuốc gây độc cho thận (ví dụ như aminoglycosid, thuốc lợi tỉểu, cảc hợp chẳt
bạch kỉm, vả cyclosporin) có khả năng chậm đâo thải Pemetrexed. Những kểt hợp nảy thải được sử dụng
một cách thận trọng. Nếu cần thìết, nên theo dõi cẩn thận độ thanh thải creatinin
Mặc dù lỉếu cao NSAID như ibuprofen (400 mg, 4 lần/ ngảy) vả acid acetylsalicylic (1,3 mg] ngảy) có
thế được dùng cùng với Pemetrexed ở nhũng bệnh nhân có chức nãng thận bình thường (độ thanh thải
creatinin > 80 ml | phút), nên cần thận trọng khi sử dụng cảc liều bởi vì chúng có thể lảm giảm việc loại
bộ Pemetrexed vả do đó lâm tăng sự xuất hiện cảc tác dụng phụ do Pemetrexed. Bệnh nhân suy thận nhẹ
đên trung bỉnh (độ thanh thải creatinine 45- 79 ml/ phút) nên tránh sử dụng đổng thời Pemetrexed với
NSAID 2 ngảy trưởo và 2 ngảy sau khi dùng Pcmetrexed.
Do thỉếu các dữ liệu về thời gian bản thải liên quan đến khả năng tương tác giữa Pemetrexed vả NSAID
(ví dụ, piroxicam hoặc refecoxỉb), tất cả các bệnh nhãn dùng NSAID nên dùng 'n đoạn ít nhẩt lả 5
ngảy trước và 2 ngảy sau khi điếu trị Pemctrcxed Nếu cân thiết dùng đồng thời mễtìNSAID, bệnh nhân
phải được theo dõi cân thận độc tính, đặc biệt lả suy tủy, độc tính trên thận và đường tiêu hóa
Tương Ia'c thường gặp cho tất cả lhuốc gây độc lế bâo
Việc sử dụng diếu trị chống đông là thường xuyên do nguy cơ huyết khối cao ở những bệnh nhân ung
thư. Sự thay đối tình trạng đông mảu trong co địa bệnh nhân cao vả khả nãng tương tảc với thuốc chống
đông má… và hóa trị iiệu yếu câu một tân số tãng INR (International Normalized Ratio) theo dõi, nêu
phải quyết định để điếu trị bệnh nhân với thuốc chống đông mảu.
Do tình trạng suy giảm mỉễn dịch cùa bệnh nhân ung thư, việc sử dụng đồng thời của thuốc độc vởỉ tế
bảo với vaccine không được khuyến cảo (trừ vaccin sốt vảng da, đó lả chống chỉ định) cho nguy cơ mắc
bệnh hệ thổng, với các hiệu ứng có thể gây tử vong. Sử dụng một loại văc xỉn bẫt hoạt nêu có. (ví dụ,
bệnh bại liệt)
Tác nhăn hóa lrị liệu
ch
Í"l
Cisplatỉn (thuốc điếu trị ung thu) không ảnh hưởng đến dược động học cùa Pernetrcxed vả Pemetrexcd
không gây thay đổi dược động học cứa toản bộ platin.
Vitamin '
Uống acid folic hay tiêm bắp vitamin Blzcùng lúc không ảnh hưởng đên dược động học cứa Pemetrexed
Chuyến hóa lhuổc bởi enzyme cytochmme P450 \ '
Kết quả nghiên cứu in vitro trên mỉcrosome gan người dự đoản răng pcmetrexed sẽ không gây ra ức chế
quả trinh chuyến hóa thải trừ cùa chuyến hóa thuốc bới enzyme CYP3A, CYP2D6, CYP2C9 vả CYPIA2
có ý nghĩa lâm sảng. Chưa có nghìên cứu nảo xảo định khả năng cảm ứng cùa isoenzyme cytochrome
P450 bởi vì Pemctrexed không gây ra bất cứ cảm ứng men nảo có ý nghĩa.
Aspirin
Khỉ uống Aspirin liều thấp hoặc trung bình (325mg mỗi 6 giờ), không ảnh hướng đến dược động học cùa
pemetrexed. Ở liếu cao (> 1,3g! ngảy), aspirin có thế lảm gỉảm sự bải tỉết pcmetrexed vả vì vậy lâm tăng
tảc dụng phụ.
Thuốc gây độc cho thận:
Tương tảo dược dộng học có thể xảy ra (iảm chậm thải trừ pemetrexed).
Probenecid
Tương tảc dược động học có thể xảy ra (lảm chậm thải trù pcmetrcxcd). Tương tác dược động học cũng
có thể xảy ra với các chất khảo bảì tiết ở ống thận.
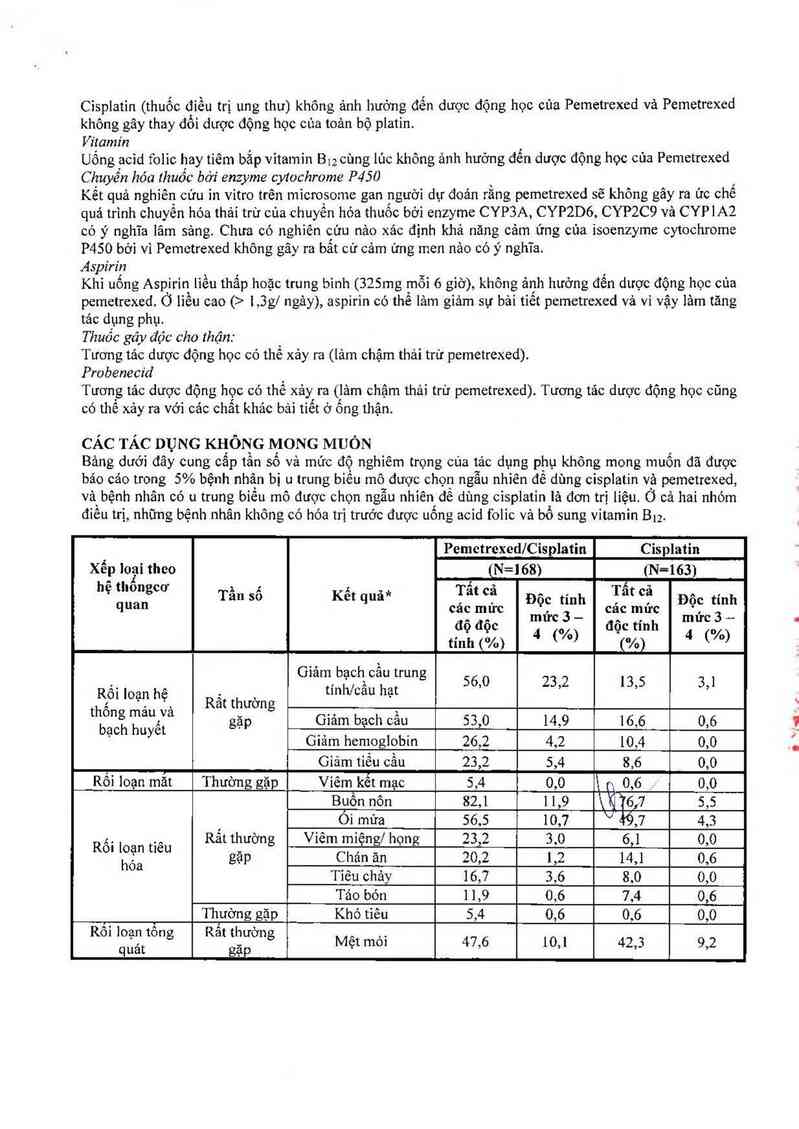
CÁC TÁC DỤNG KIỊÔNG MONG MUÔN
Bảng dưới đây cung câp tân sô và mức độ nghỉếm trọng của tác dụng phụ không mong muốn đã được
bảo các trong 5% bệnh nhận bị u trung biếu mô được chọn ngẫu nhiên để dùng cisplatin vả pcmetrexcd,
vả\bệnh nhân có u trung biên mô được chọn ngẫu nhiên để dùng cỉsplatin lá đơn trị liệu. Ở cả hai nhóm
điêu trị, những bệnh nhân không có hóa trị trước được uống acid folic vả bổ sung vitamin Blz.
Pcmctrexed/Cisplatin Cisplatin
Xếp loụi thco [N=168) (N-163)
hê thon cơ :. .' , .^’ " "
' g Tan so Kết qua* 5“ °Ễ Độc tính 5²“ °? Đôc tính
quan cac mưc , cac mưc ' ,
., . mưc 3 — .. , mưc 3 ——
đọ đợc 4 (°/) đọc tinh 4 (,y)
tinh (%) “ (%) °
›. Giam, bạchìcau trung 56,0 232 135 3’1
Rôi loan hê : , tmh/cau hạt
thống niảu vả Rat thương . ~
, gặp Giảm bạch câu 53,0 14,9 16,6 0,6
bạch huyct .. .
Cuam hemoglobin 26,2 4,2 10,4 0,0
Giảm tiếu cầu 23,2 5,4 8,6 0,0
Rôỉ loạn mắt Thường gặp Viêm kết mạc 5,4 0,0 \ p, 0,6 0,0
Buồn nôn 82,1 1 1,9 \)Qìớfi 5,5
, Oi mứa 56,5 10,7 V 49,7 4,3
R ố i loan tiêu Rãt thường Viêm miệngf họng 23,2 3,0 6,1 0,0
hớa gặp Chán ăn 20,2 1,2 14,] 0,6
Tỉêu chảy 16,7 3,6 8,0 0,0
Tảo bón ] 1,9 0,6 7,4 0,6
, Thuờng gặp Khó tiêu 5,4 0,6 0,6 0,0
Rôỉ loạn tổng Rắt thường … ..
quảt gặp Mẹt mm 47,6 10,1 42,3 9,2
id :
h s
Rối loạn chuyến
hóa và dinh Thường gặp Mất nước 6,5 4,2 0,6 0,6
dưỡng
Rồi loạn hệ thần RatẵẫỂm'g Bẹ"Ệìẫễaẵuễịình “ 10,1 0,0 9,8 0,6
kmh Thường gặp Xác trộn hương vị 7,7 0,0*** 6,1 0,0***
Creatinin tăng cao 10,7 0,6 9,8 1,2
Rối ioạn thận Thường gặp Giảm ớộ_tmm thải 1 6,1 0’6 17,8 1,8
creatinin **
Rối loạn da vả tổ Thường găp Phát ban 16,1 0,6 4,9 00
chức dưới da ' Rụng tóc 11,3 0,0*** 5,5 0,0***
*** Tham khảo CTC version 2 cùa National Cancer Institute đế có thêm thông tỉn cho từng mức độc
tính. Giới hạn CTC từ nguồn “Renal/Genitourinary-Other”.
*** Theo CTC version 2 cùa National Cancer Institute, rối [oạn vị gỉảc vả rụng tỏc chỉ nên được báo cảo
là mức 1 hay 2.
Rắt thường gặp_ > 10%; thường gặp > 1% vả <10% (mục đích cùa bảng nảy, ngưỡng 5% được sử dụng
để người báo cáo chỉ tất cả các mức ảnh hưởng của pemetrexed kết hợp cisplatin).
Bảo cảo độc tính CTC liên quan có ý nghĩa lâm sảng trong >1% vả <5% (thường gặp) cùa các bệnh nhân
được chỉ định ngẫu nhiên đỉếu trị cisplatin kết hợp pemetrexed lả: tăng AST, ALT vả GGT (gamma
glutamil transferase), nhỉễm trùng, sốt, sốt gỉảin bạch câu, suy thận, đau ngực vả mề đay.
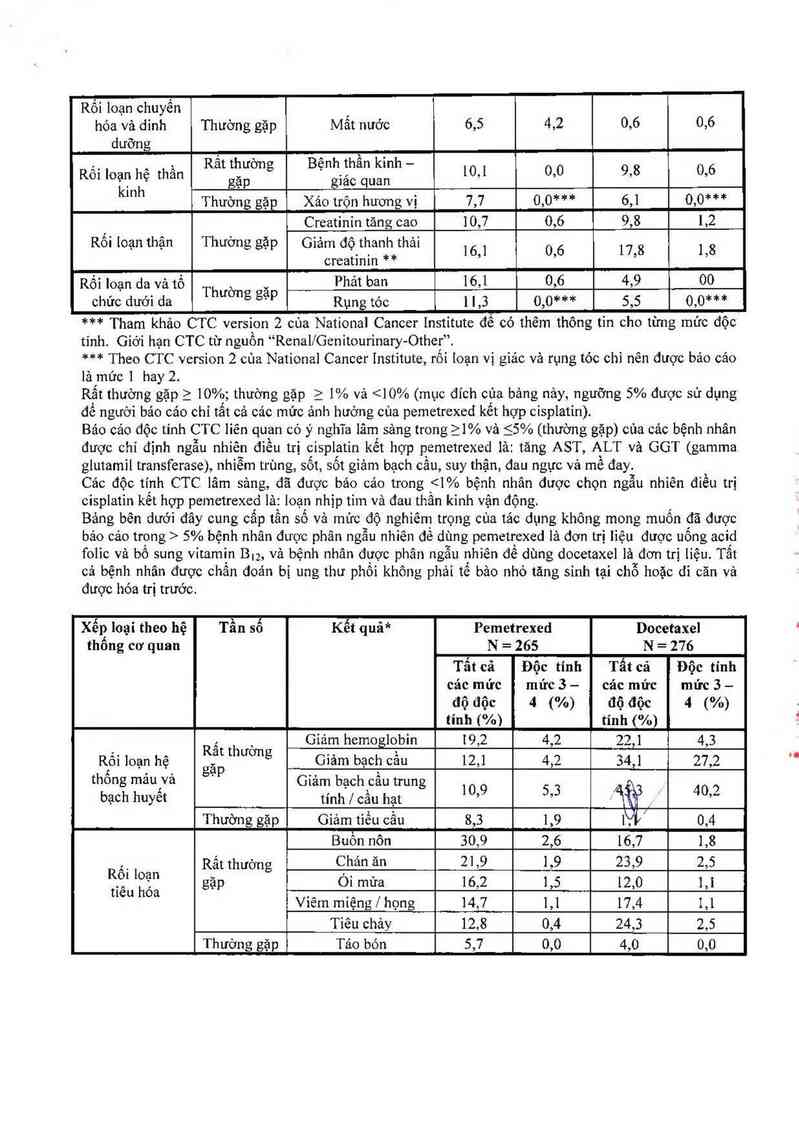
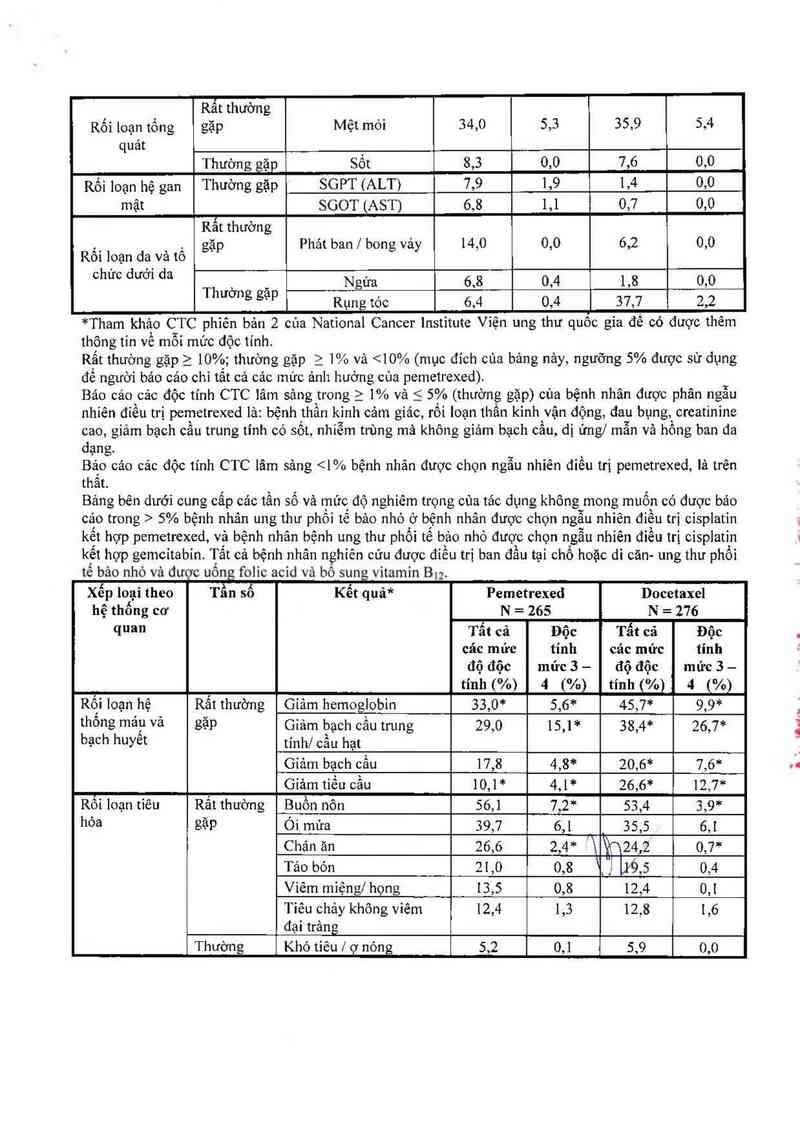
Cảo độc tính CTC lâm sảng, đã được bảo cáo trong 5% bệnh nhân đuợc phân ngẫu nhiên để dùng pemetrexed lá đơn trị lỉệu được uống acid
folic vả bổ sung vitamin B12, vả bệnh nhân được phân ngâu nhỉến để dùng docctaxel lá đơn trị iiệu. Tắt
cả bệnh nhân được chần đoản bị ung thư phổi không phải tế bảo nhỏ tãng sính tại chỗ hoặc di căn và
được hóa trị trước.
Xếp loại theo hệ Tần số Kết quã* Pemetrexed Docetaxel
thống cơ quan N = 265 N = 276
Tẩt cã Độc tính Tất cả Độc tính
các mức mức 3 — cảc mức mức 3 —
độ độc 4 (%) độ độc 4 (%)
tính (o/o) tính (%)
_, , Giảm hemoglobin 19,2 4,2 22,] 4,3
Ỉ1Ìtội loạn hệ Ểẵế thương Giảm bạch cầu 12,1 4,2 34,1 27,2
t ôn máu vả ' Giảm bach cẩu trun
bạcgh huyết tinh`i cầu hạt g 10’9 5’3 ẢiỄỄ - 40’2
Thường gặp Giảm tiếu cầu 8,3 1,9 Ni 0,4
Buồn nôn 30,9 2,6 16,7 1,8
A,_ Rất thường Chản ăn 21,9 1,9 23,9 2,5
RFìl lỄỂ“ gặp Ỏi mửa 16,2 1,5 12,0 1,1
tteu oa Viếm miệng / họng 14,7 1,1 17,4 1,1
Tiêu chảy 12,8 0,4 24,3 2,5
Thường gặp Táo bón 5,7 0,0 4,0 0,0
Rất thưởng
Rối loạn tổng gặp Mệt mòi 34,0 5,3 35,9 5,4
quảt ,
Thường gặp Sôt 8,3 0,0 7,6 0,0
Rồi loạn hệ gan Thuờng gặp SGPT (ALT) 7,9 1,9 1,4 0,0
mật SGOT (AST) 6,8 1,1 0,7 0,0
Rất thường
._ , gặp Phảt ban | bong vảy 14,0 0,0 6,2 0,0
Rô1 loạn da và tô
°hưc dưffl d“ Th , _ Ngứa 6,8 0,4 1,8 0,0
ương gạp Rụng tóc 6,4 0,4 37,7 2,2
*Tham khảo CTC phiên bản 2 cùa National Cancer Institute Viện ung thư quôc gỉa đề có được thêm
thộng tin về mỗi mức độc tính
Rất thường gặp_ > 10%; thường gặp > 1% vả <10% (mục đích cùa bảng nảy, ngưỡng 5% được sử dụng
để người báo cảo chỉ tất cả cảc mức ảnh hưởng của pemetrexed)
Báo cáo cảc độc tính CTC lâm sảng trong_ > 1% và < 5% (thường gặp) của bệnh nhân được phân ngẫu
nhiên đỉều trị pemetrexed lả: bệnh thần kình cảm giác, rối loạn thần kinh vận động, dau bụng, creatinine
cao, giảm bạch câu trung tính có sốt, nhỉễm trùng mã không gỉảm bạch cầu, dị ứng/ mẫn vả hồng ban đa
dạng.
Bảp cảo cảc độc tính CTC lâm sảng 5% bệnh nhân ung thư phồỉ tế bảo nhỏ ở bệnh nhân được chọn ngẫu nhiên điểu trị cisplatỉn
kết hợp pcmetrexed, vả bệnh nhân bệnh ung thư phổi tế bảo nhỏ được chọn ngân nhiên điểu trị cisplatỉn
kết hợp gemcỉtabỉn. Tất cả bệnh nhân nghỉên cứu được đỉều trị ban đẳu tại chổ hoặc di căn— ung thư phổi
tế bảo nhỏ vả dươc uống folic acid vả bô sung vitamin Bg.
Xếp loại theo Tần số Kết quâ* Pemetrexed Docetaxel
hệ thống cơ N = 265 N = 276
quan Tẫt cả Độc Tất cả Độc
các mức tính các mức tinh
độ độc mức 3 — độ độc mửc 3 —
tính (%) 4 (%) tính (%) 4 (%)
Rội loạn hệ Rắt thường Gỉảm hemoglobin 33,0” 5,6* 45,7²“ 9,9*
thông máư Vả gặp Giảm bạch cầu trung 29,0 15,1 * 38,4* 26,7*
bạch huyêt tínhf cầu hạt
Gỉảm bạch cầu 17,8 4,8²“ 20,6* 7,6*
Gỉảm tiều cầu 10,1* 4,1* 26,6* 12,7*
Rối loạn tỉêu Rắt thường Buồn nôn 56,1 7,2* 53,4 3,9*
hóa gặp Ói mừa 39,7 6,1 _ 35,5 6,1
Chản ăn 26,6 2,4* `'\ %24,2 0,7*
Tảo bón 21,0 0,8 _",1 9,5 0,4
Viêm mìệng/ họng 13,5 0,8 12,4 0,1
Tiêu chảy không viêm 12,4 1,3 12,8 1,6
đại trảng
Thường Khó tiêu / ợ nóng 5,2 0,1 5,9 0,0
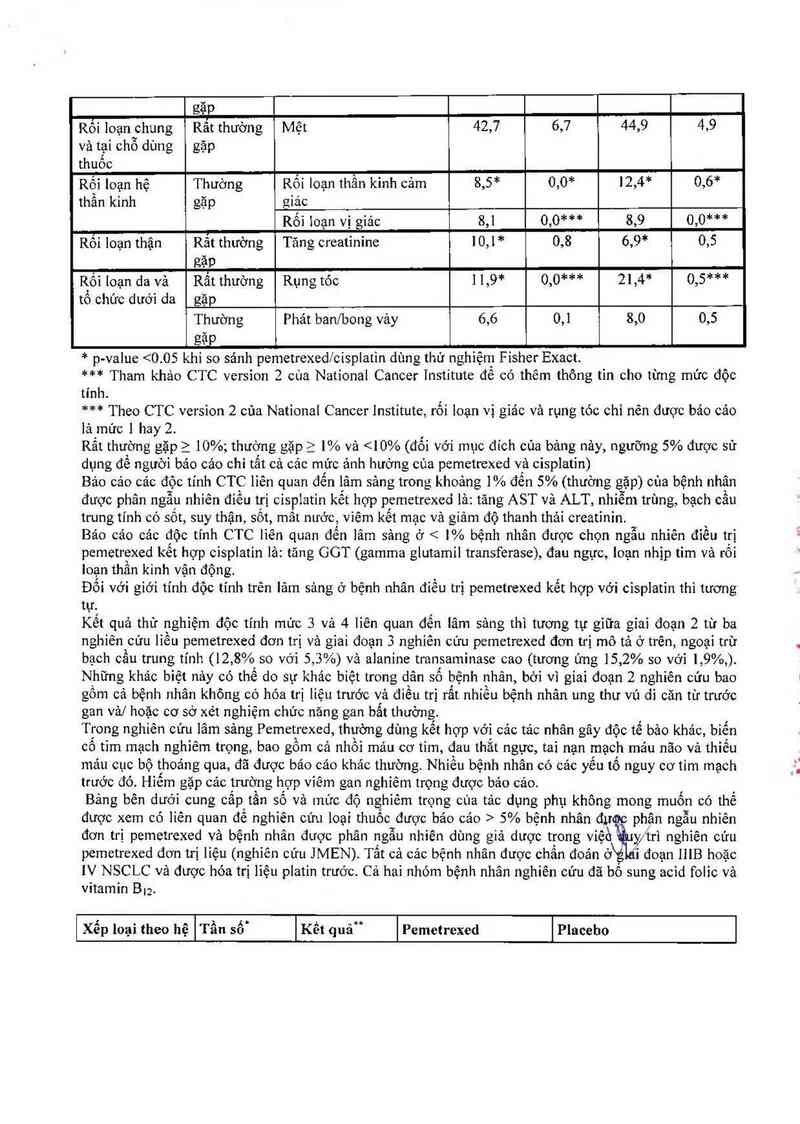
1.4-1.—
gạp
Rối loạn chung Rất thường Mệt 42,7 6,7 44,9 4,9
và tại chỗ dùng gặp
thuốc
Rối loạn hệ Thường Rối loạn thần kinh cảm 8,5* 0,0* 12,4* 0,6*
thẩn kinh gặp giác
Rối Ioạn vị giảc 8,1 0,0*** 8,9 0,0***
Rôi loạn thận Rất thường Tâng creatinine 10,1* 0,8 6,9* 0,5
gặp
Rối loạn da vả Rất thường Rụng tóc 1 1,9* 0,0*** 21,4* 0,5***
tổ chửc dưới da gặp
Thường Phát ban/bong vảy 6,6 0,1 8,0 0,5
gạp
*p- -value <0. 05 khi so sánh pemetrexedmisplatỉn dùng thử nghìệm Fisher Exact.
*** Tham khảo CTC version 2 của National Cancer Institute để có thêm thông tìn cho từng mức độc
tính.
*** Theo CTC version 2 cùa National Cancer Institute, rổi loạn vị giác và rụng tóc chỉ nên được báo cáo
lả mức 1 hay 2.
Rất thường gặp_ > 10%; thường gặp_ > 1% vả <10% (đối với mục đích của bảng nảy, ngưỡng 5% được sử
dụng để người báo cảo chỉ tất cả cảc mức ảnh hưởng của pcmetrexed vả cisplatin)
Bảo cảo cảc độc t1nh CTC liên quan đến lâm sảng trong khoảng 1% đến 5% (thường gặp) của bệnh nhận
đuợc phân ngẫu nhiên điều trị cisp1atin kết hợp pcmetrexed lả: tãng AST vả ALT, nhỉễm trùng, bạch cầu
trung tính có sôt, suy thận, sốt, mât nuớc, viêm kễt mạc và giảm độ thanh thải creatinin.
Bảo cảo cảc độc tính CTC liên quan đến lâm sảng ở < 1% bệnh nhân được chọn ngẫu nhiên điểu trị
pemetrexed kểt hợp cisplatin lả: tăng GOT (gamma glutamil transferase), đau ngực, loạn nhịp tim và rối
loạn thẳn kinh vận động.
Đối vởi giới tính độc tính trên lâm sảng ở bệnh nhân điều trị pemetrexed kểt hợp với cỉsplatìn thì tương
tự.
Kết quả thử nghiệm độc tính mức 3 vả 4 lỉên quan đến lâm sảng thì tương tự gỉữa gíaỉ đoạn 2 từ ba
nghiên cứu lỉều pemetrexed đơn trị và gỉai đoạn 3 nghiên cứu pemetrexed dơn trị mô tả ở trên, ngoại trừ
bạch cầu trung tính (12,8% so với 5,3%) vả alanine transaminase cao (tương lúng 15,2% so vởi 1,9%,)
Những khác biệt nảy có thể do sự khác biệt trong dân số bệnh nhân, bởi vì giai đoạn 2 nghiên cửu bao
gôm cả bệnh nhân không có hóa trị liệu trước và đìều trị rắt nhiễu bệnh nhân ung thư vú di căn từ trưởo
gan vả/ hoặc cơ sở xét nghiệm chức năng gan bất thường
Trong nghiên cứu lâm sảng Pemetrexed, thường dùng kết hợp với cảc tác nhân gây độc tế bảo khảc, biến
cô tim mạch nghiêm trọng, bao gồm cả nhồi máu cơ tim, đau thắt ngực, tai nạn mạch máu não vả thiếu
máu cục bộ thoảng qua, đã được bảo các khảo thường. Nhiều bệnh nhân có các yếu tố nguy cơ tìm mạch
trưởo đó. Hìễm gặp cảc trường hợp vỉêm gan nghỉêm trỌng được bảo cảo.
Bảng bên dưới cung câp tần sô và mức độ nghỉêm trọng cùa tảc dụng phụ không mong muốn có thế
được xem có liên quan để nghiên cứu loại thuốc được bảo các > 5% bệnh nhân đươc phân ngẫu nhiên
đơn trị pemetrexed và bệnh nhân được phân ngẫu nhiên dùng giả dược trong vỉệè yỵtrì nghìên cứu
pemetrexed đơn trị liệu (nghỉẽn cứu JMEN). Tất cả cảc bệnh nhân được chẩn đoản ở\g 1 đoạn 1118 hoặc
IV NSCLC và được hóa trị liệu platin trưởc Cả hai nhóm bệnh nhân nghỉên cứu đã bổ sung acid folic vả
vitamin B|2.
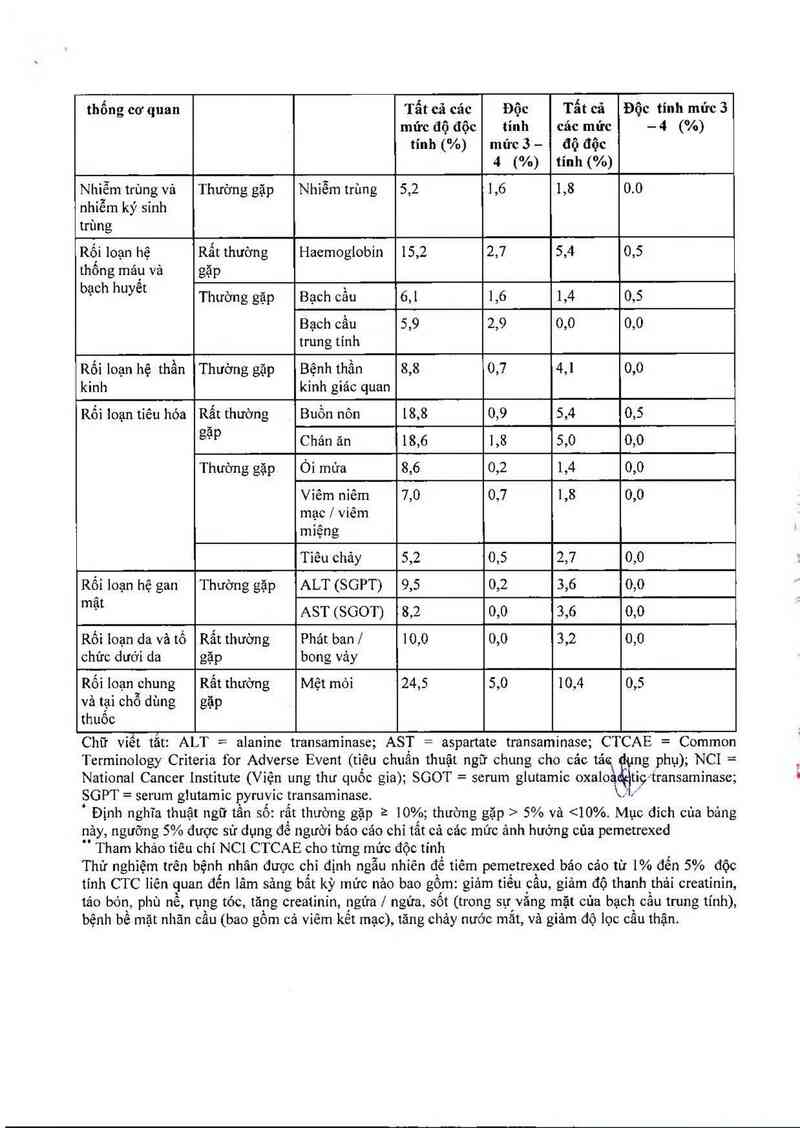
Xếp loại theo hệ Tần so Kết quả" Pemetrexed Placeho
thống cơ quan Tẩt cả các Độc Tẩt cả Độc tính mức 3
mức độ độc tính các mức — 4 (%)
tính ("/o) mức 3 — độ độc
4 (%) tính (%)
Nhiễm trùng vả Thưởng gặp Nhìễm trùng 5,2 1,6 1,8 0.0
nhỉễm ký sỉnh
trùng
Rố_1 loạn hệ Rất thường Haemoglobin 15,2 2,7 5,4 0,5
thông máư vả gặp
bạch huyêt , - —.
Thương gạp Bạch cau 6,1 1,6 1,4 0,5
Bạch cầu 5,9 2,9 0,0 0,0
trung tỉnh
Rối loạn hệ thẫn Thường gặp Bệnh thần 8,8 0,7 4,1 0,0
kinh kinh giác quan
Rối 1oạn tỉêu hóa Rất thường Buồn nôn 18,8 0,9 5,4 0,5
gặp Chản ăn 18,6 1,8 5,0 0,0
Thưởng gặp Óỉ mứa 8,6 0,2 1,4 0,0
Viêm niêm 7,0 0,7 1,8 0,0
mạc / viêm
miệng
Tiêu chảy 5,2 0,5 2,7 0,0
Rối loạn hệ gan Thường gặp ALT (SGPT) 9,5 0,2 3,6 0,0
mạt AST (SGOT) 8,2 0,0 3,6 0,0
Rối Ioạn da và 16 Rất thường Phát ban/ 10,0 0,0 3,2 0,0
chức dưới da gặp bong vảy
Rối Ioạn chưng Rất thường Mệt mỏi 24,5 5,0 10,4 0,5
và tg_1i chỗ dùng gặp
thuôo
Chữ viềt tắt: ALT = alanỉne transaminase; AST = aSpartate transaminase; CTCAE = Common
Terminology Crỉterỉa for Adverse Event (tiêu chuẩn thuật ngữ chung cho cac tac ng phụ); NCI—
National Canccr Institute (Vỉện ung thư quôc gìa); SGOT = serum glutamỉc oxaloadĨtic- transaminase;
SGPT- — serum giutamic pyruvíc transaminase. \ ,
Định nghĩa thuật ngữ tần sô: rất thường gặp ² 10%; thường gặp > 5% và <10%. Mục đich cùa bảng
nảy, ngưỡng 5% được sử dụng để người báo cáo chỉ tất cả các mức ảnh hưởng của pemetrexed
Tham khảo tỉêu chí NCI CTCAE cho tùng mức độc tính
Thử nghỉệm trên bệnh nhân được chỉ định ngẫu nhỉên đề tiêm pemetrexed báo cảo từ 1% đến 5% độc
tính CTC lỉên guan đến lâm sảng bất kỳ mức nảo bao gồm: gỉảm tiểu câu, giảm độ thanh thái creatinin,
tảo bón, phù nê, rụng tóc, tăng creatinin, ngứa | ngứa, sốt (trong sự văng mặt của bạch cầu trung tính),
bệnh bề mặt nhăn câu (bao gôm cả viêm kễt mạc), tăng chảy nước mắt, vả giảm độ lọc cầu thận.
hử nghiệm trên bệnh nhân được chỉ định ngẫu nhiên để tìêm pemetrexed bảo cảo từ <1% độc tinh CTC
liên quan đển lâm sảng bao gồm: giảm bạch câu trung tính có sõt, phản ửng dị ứng / mẫn cảm, rối loạn
thằn kinh vận động, hồng ban đa dạng, suy thận, và loạn nhịp nhanh trên thất
Tỷ. lệ phản ứng phụ được đảnh gỉá cho nhưng bệnh nhân điều trị < 6 chu kỵ tỉêm pemetrexed, và so sánh
với nhũng bệnh nhân điều trị > 6 chu kỳ tiêm pemetrexed. Quan sát cho thây tăng phản ứng bất lợi (tất cả
cảc mức) khi điều trị lâu hơn, tuy nhiên, sự khảc biệt tảc dụng phụ trong mức 314 không có ý nghĩa thống
kê.
Báo các tự phát hậu măi
Cảo tậc đụng phụ lìên quan đến đỉễu trị đã được bảo cảo kể từ khi Pemetrexed đã được đưa ra thị trường
bao gôm:
Phán ứng chung và tại chỗ dùng thuốc:
Trường hợp phù nề đã được báo cảo ở những bệnh nhân được điều trị với pcmetrcxcd.
Tiêu hóa:
Trường hợp vỉêm đại trảng hiểm gặp ở những bệnh nhân được đỉều trị vởỉ pemetrexed.
Hô hấp:
Các trường hợp vỉêm phổi mô kẽ hiếm gặp ở những bệnh nhân được điều trị với pemetrexed (<0, 1% số
bệnh nhân được đỉểu trị với pemetrexed)
Chẩn lhương, ngộ độc vờ các biến chửng:
Hiếm cảc trường hợp cùa bức xạ 11… hổi đã được bảo cáo ở những bệnh nhân trước đó trong điều trị
bằng xạ trị.
Da ,
Tình trạng bóng nước toân thân đã được báo cảo bao gồm hội chứng Stevens-Johnson vả hoại tử biêu bì
độc, mả trong một số trường hợp đã tử vong.
Thóng báo cho bác sĩ những tác dụng khóng mong muốn gặp phải khi dùng lhuốc.
QUÁ LIỀU VÀ CÁCH xứ TRÍ-
Đã có vải trường hợp Pemetrexed quả liềư. Cảc trường hợp ngộ độc bảo các bao gồm giảm bạch cầu,
thiếu mảu, giảm tìểu câu, viêm niêm mạc và phảt ban.
Cảc biến chứng của quá liều bao gồm ức chế tủy xương với bìếu hỉện giảm bạch cầu, giảm tiếu cầu vả
thỉếu máu. Bên cạnh đỏ, có thể thấy nhiễm trùng có hoặc không có sốt, tiêu chảy và viêm niêm mạc. Nếu
quả liễu xảy ra, bác sĩ điểu trị thục hỉện bìện pháp hỗ trợ chung khi cằn thiết. Dùng quả lỉều pemetrexed
bao gồm sử dụng cảc leucovorin vả thymídine. Việc sử dụng calci folinat/ acid folinic cũng có thể được
xem xét trong vìệc dùng Pemetrexcd quá liều.
Trong cảc thử nghiệm lâm sảng, dùng leucovorin cho phép CTC mức 4 giảm bạch cầu kéo dải > 3 ngảy,
vả ngay lập tức CTC mức 4 giảm tìểu cầu, mửc 3 giảm tỉểu cầu lìên quan đến chảy máư hoặc vỉêm niêm
mạc mức 3 hoặc 4. Cảo liều tiêm tĩnh mạch sau đây và lịch trình dùng thuốc cùa 1eucqv 1~in ược khuyến
cảo sử dụng tiêm tĩnh mạch: 100 mg/m2 , tiêm tĩnh mạch một lần, tỉếp theo lá leucovor mg/mz, tỉêm
tĩnh mạch mỗi 6 giờ trong 8 ngặy.
Khả nảng cùa Pcmetrexed bị thâm tảch lá không rõ.
BÁO QUẢN: Bảo quản nơi khô, đưới 30°C.
Pemetrexed được ổn định trong vòng 48 gỉờ sau khi pha và pha loãng dung dịch pha tiêm natri cloric
0,9%, đề ở nhiệt độ 28 0C.
ĐỂ THUỐC TRẢNHXIA TẤM TAY TRẺ EM
HẠN DÙNG: 24 thảng kế từ ngảy sản xuất. KhônMốẹ quá hạn cho phép.
TIÊU CHUẨN: Nhà sản xuất
Tên & địa chỉ Nhà sân xuất:
GLENMARK GENERICS S.A.
Calle 9 Ing. Meyer Oks N° 593
Parque Industrial Pilar
Provincia de Buenos Aires, Argentina
TUQ. CỤC TRUỞNG
P.TRLỦNG PHÒNG
./1ỷuyễn Jẩty Jẳìng
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng