















c1 (` QUÁN LÝ m"ợc
ĐÀ PHÊ Di.ìYỆT
Lán đưu/iẩỔ/iLi
io Y TẾ
'IIUG famzơ ax3
l uotsnịui m| uoịmịos ioi momou
s… ooz
OIIỊqUỊỊOWOa
oUVZWBĐ
I›OSL `lA
Rx Thuốc bảnthoođơn,
Hộp 1 to nợ!đđng khú_cnưa 200 mg
Gemcitabine. đùng đépha dung
dich uèm truyèn iĩnh mach.
Bảo quán dưới 30'C.
bè 11: tảm tzytré em.
Đọckỷ huớng dắn sủ dụng trvởc
khidủng.
Chíđịnh, mmdư1g,chóng chiớtnh
va oớcciáu h1ẻuiưuy'khát: xinđọc
mngtơ hướng đẫn sửđung
SĐK, XX-XXXX-XX.
Số IđSX, NSX, HD xem Lot .
Mfg Dae, Exp ưen bao bt
Sản xuấtbới' EỈi tlly and Company,
molanapolis. 1N46285 Mỹ.
DNNKrViMEDiMEX BINH DUONG.
linh Binh Dmmg
Cảc mỏng tin khác dè nghị xem trong
lơ huớng dản sử dung kem theo
DSHS
_ iililii
Il!^ I
I
Mannitoi (E421). sodium
aceiate. hydrochlonc acid and
soo:um hyđroxide See leatlet
tot iurther mtormation
Unopened v1ai: Siote beiow 30°C
Keep out of the reach and sighi
oi chnidren.
Manuiacruređ bw
Eli Liliy and Company
' Indianapolis. IN 46285, USA
*1 __
\
GEMZAR°
Gomoltlblno
200 mg
powder for solution ior iniusion
Each mai contans gemcitabine
hydrochioriđe equxvnlent to 200 mg
gemcutabme
zi iẨ/lÝ ibn Ữ ẩf’l ,f/4/
For intravenous use ahev
tỉtuhon
To reconstltuia. adc at least 5 mi
oi 0.9°é Sođium Chloride lnịection
Shake to đissoive.
Fiead the leailet lor the shelt Iiie
ot the ieconsiituled product.
Do not retngetate the
reconstituteđ soiuiion
Discaid unuseđ contents
appropriateiy
FC ọaoo VNS
NL34OOEAX_UPIVI . pdf
10l2'7/10 3:09116 PM
for Invuuum uu … muưm
m mt lúiuưlb tu ucmM Mn
Im h nmue bamuetơe wo
10me zđii:tluutảưilơiưtkSơđiưiittbư
lmnm Smhwissulu
umuncd vit Stue belơw WE
hi single in om
VENDOR DRAWING NO: N/A
VIEW: PRiNTED SIDE UP
DIMENSIONS: L-77 mm, w—za mm. R -16 mm
VERSION: 1
comns:
EXP DATE: EXP: BLACK NL 3400 EAX
ẸẬJ.CHẶQI.LỌ£ 485 NL 3400 EAX
ã W _ _ _ _ _ 328 NL 3400 EAX
Ễ AFF. BARCODE nen J uth -J EAN `J DATAMATRIX g lMPRINT BLACK \ D-7OỀO~LỂin
E ffl … _,ffl _ Ễ utiTii-UiWTERFEiTit—ib FOiL ii-7ugđ-Lnư
ẫ PACKAGING sưa: .JINDY onv J DDAO -iilPARENTERAL o
ẵ J PỤỄRTO R100 … … g OTHER COATỈNG D-7020-LE01
omen REGULATED ITEMS. N/A cnoưeo BYI MDL DATE: 27 oc1 zo…
Engọọgc venscon_ng NL3fffl_EẬX / P1V1
SIGNATUREI DATE:
PMOFREADING: um: _ o-mo-ưm
Ệ Ễ FINISHING LINE NO: 1c229 ua
Ễ ỄẸỂỆỄẾỘỊẸRI DATE. ễ ENGiNEERING APPROVAL. Steven M Sorenson
'; ! DKTE;it June 2010
Ế PPMOA DATE: … ENTERED BYi 0L 11 June 2010 Non Vainish
o-mzo-Leoz
meno- n-1ozo in…1ozo_1zm
APPROVED BY, Ann HữgiS
DATE: 11 June 2010
emtnen BY. DL11JmeZOlO ^nticwnteffeithofml _
D-7020-LE03
FINISHING LINE No.. 10229 L13
ENGINEERING APPROVAL Steven M Sorenson
DATE; 11 June 2010
ENTERED BV; DL 11 June 2010 Sctecn White I`ẸZìi
D—7020—LE04
FINISHING UNE NO; 16229 L 13
ENGINEERING APPROVAL. Steven M Sorenson
011sz 11 June 2010
MER'S ÚPRM WER'S WM
ENTERED BY: DL 11 June 2010
Impiint s… _
NLNDOEẨX_IìPIVI .pđf
10|27/10 J:CB:IB “PM
Fơ im…u \ll ưiu l…m
Do not leunh n im… ulmim
n… n pnciqe Iutll m… usa
10 mm… eđđ il imi 5liđ 0 9% Scđlưl mmlm
Iiư1ởl ữlửt 10 disaùl
meliedVii She blbn30'C
comns:
EXP. DATE exp. BLACK NL 3400 EAX
BATCH NO: Lot 485 NL 3400 EAX
ễ MFG DATE: Mfu. Date; 328 NL 3400 EAX
ẫ AFF BARGODE nve: J upc u EAN 'J DATAMATRIX g lMPBỂN_Ĩ BLACK _ DĨỌỂỌLEOỂ
o _ JRSS DNIA OOTHER ẳ N11li_.iJi_WiEiifEiilNGFOiL D-iUáiJ-ƯJJ.
Ế PACKAGING sne- .! mm DRY J DDAO n PARENTERAL u
ẫ mm mco ÙomEn COATING o-7ozo-ưm
OTHER REGULATED lTEMS- NIA CREATED av: MDL DATE: 27 ocr zmo
nen cooe & vens10n no: NL a4oo … ! P1V1 __
SIGNATURE: DATE;
Ipnoomamne. WE o…rozo-ưm
ễ nmsnmc une … 1c229 ua
Ể ẸỂỂỆỄẾĨỊỔẺ DATET Ễ'Ẻ ENGiNEERING APPHOVAL: Steven M, Sorenson
› ỉ one: 11 June 2010
ẵi Pmm, WE ả ENTERED av: DL 11 June 2010 Non Vamish
D-7020-L802
DIE no.- n-mzo (D-7020_12A11
APPROVED BY: Ami Hargis
FINISHING UNE NO… 10229 L13
ENGINEERING APPROVALỊ Steven M Sorenson
DATE: 11 June 2010
ENTERED BY: DL 11 June 2010 Screen White 153;
D-7020—LE04
FINISHING UNE no.: 10229 L 13
ENGINEERING APPROVALz Stoven M Sorensm
DATEỊ 11 June 2010
…ER'S DPRM ÚER'S mm
ENTEFIED BY: DL 11 June 2010
lmpiint Black _
o
o venoon nmwmc no: N/A Ể
g vưw: PRINTED sms UP nm; 11 June zo…
nmensons: cn mm.W—28 mm, 11 -1.6 mm _ _ ,
VERSION: 1 emenm ev: DL 11 June 2010 ^ntmnterfemnq fml _
n-mzo-ưoa
1. TÊN THUỐC
GEMZAR
z. THÀNH PHÀN ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
Môt lọ chứa Gemcitabin hydroclorid tương đương vởi 200 mg Gemcitabin.
Sau khi hoản nguyên được dung dịch chứa Gemcitabin 38 mglml
Tá~dươc
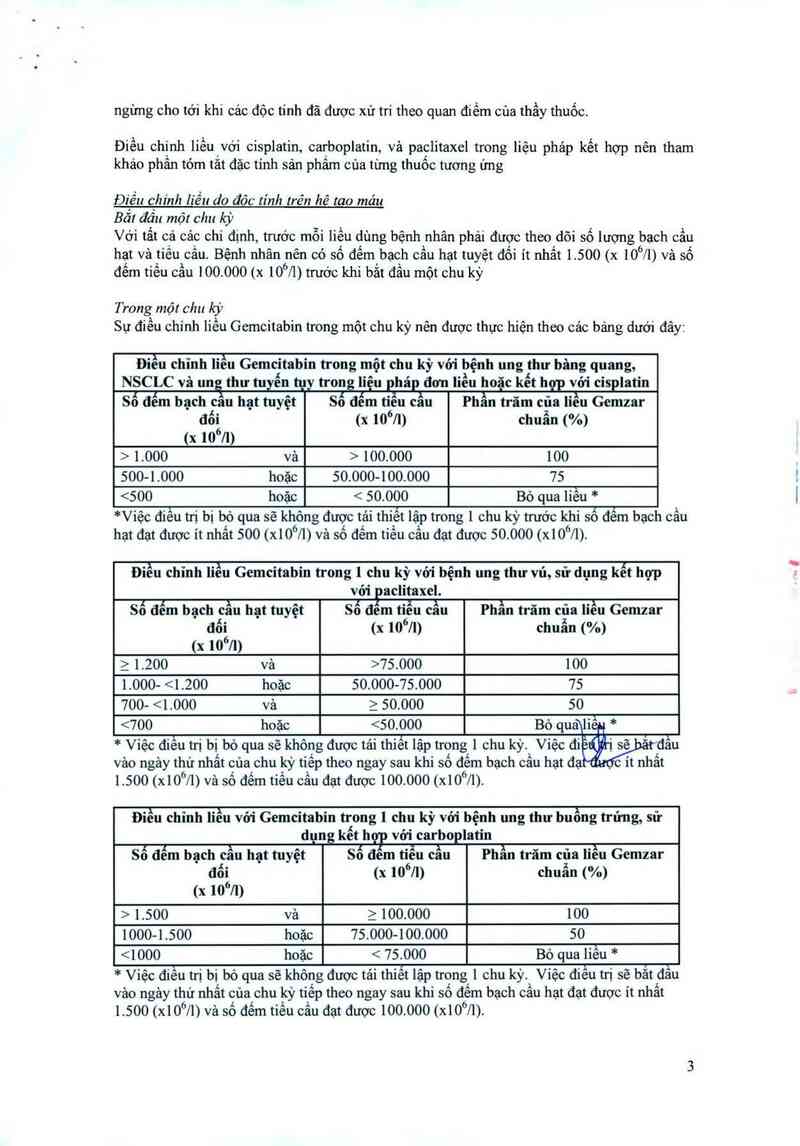
Môi lọ 200 mg chứa 3.5 mg ( 1.000 và > 100.000 100
500-l .000 hoặc 50.000-100.000 75
65 tuồi)
Gemcitabin dược dung nạp tốt ở các bệnh nhân trên 65 tuối. Không có bằng chửng cho rằng
việc điều chỉnh liếu ở bệnh nhân là cẩn thiết ngoải sự điều chỉnh đã được khuyến cảo cho tất
cả cảc bệnh nhân (xem phần 5.2).
Bẻnh nhân tre em (< 18 tuỏz')
Không khuyến cáo sử dụng Gemcitabin cho trẻ em dưới 18 tuối do khỏng có đề ủ dữ liệu
về hiệu quả và độ an toản.
4.3 Chống chỉ định
Mẫn cảm với hoat chẳt hoặc vói bất kỳ tá dược nản.
Đang cho con bú (xem phần 4.6)
4.4 Những thận trọng và cãnh bảo đặc biệt khi sử dụng
Thời gian truyền kéo dải và Tần suất liếu tăng đã được chứng minh lảm tãng độc tính.
Đôc tính trên hè tao máu
Gemcitabin có thể gây suy chức nãng tủy xương thế hiện bởi chứng giảm bạch cầu hạt trung
tính, giảm tiếu cẩu, thiếu máu.
Bệnh nhân sử dụng Gemcitabin nên được theo dỏi số đếm tiếu cầu, bạch cầu và bạch cầu hạt
trước mỗi liếu. Việc giảm hoặc điếu chỉnh liếu điếu trị nên được cân nhắc khi phảt hiện ra
hiện tượng giảm tủy xương do thuốc gây ra (xem phần 4. 2). Tuy nhiên hiện tượng ức chế tủy
xương ngăn vả thường không phải giảm liếu và hiếm khi ngừng điều trị.
Công thức mảu ngoại vi có thể tiếp tục giảm sau khi dừng sủ dụng Gemcitabin. Ở cảc bênh
4
-no I—
nhân bị suy chức năng tủy xương, nên thận trọng khi bắt đẳu điếu trị Như với các điều trị
gây độc tế bảo khảo, nguy cơ ức chế tủy xương tich lũy phải được xem xét khi điều trị
Gemcitabin cùng với cảc hớa trị khác.
Thiếu hut vế gan
Dùng Gemcitabin ở cảc bệnh nhân có đồng thời di căn gan hoặc có tiền sử bệnh lý tmớc kia
vê vỉêm gan nghỉện rượu hoặc xơ gan có thể gây trầm trọng thêm sự thiếu hụt chức năng
gan.
Nên tiến hảnh đảnh giả định kỳ cận lâm sảng chửc nãng thận và chức năng gan (gồm cả các
phép thử virút).
Nên dùng thận trọng Gemcitabin ở các bệnh nhân bị suy giảm chức năng thặn hoặc có sự
thiên hụt về gan do không có đầy đủ thông tin từ cảc nghiên cứu lâm sảng đế có thế khuyến
cáo liêu cụ thể cho những đối tượng bệnh nhân nảy (xem phân 4.2)
Dùng đồng thời với xa tri `
Dùng đổng thời với xạ. trị (dùng đông thời hoặc cảoh nhau 5 7 ngảy): Đôc tinh đã được báo
cáo (chi tiêt xin xem phân 4.5 và những khuyến cảo trong sử dụng).
Tiêm chủng naùa sốne
Không khuyên cảo sử dụng vảc xin sốt vảng vả văc xin giảm độc lực sống cho những bệnh
nhân điêu trị với Gemcitabin (xem phẩn 4.5).
Tim mach
Do có cảc ngưy cơ rối loạn tim vả/hoặc mạch, phải thận trọng đặc bìệt Với những bệnh nhân
từng có tiến sử của cảc hiện tượng tim mạch
Phôi
Cảc ảnh hưởng đến phối, đôi khi nặng (như phù phổi, viêm phối kẽ hoặc hội chứng nguy
ngập hô hấp ở ngưới iớn (ARDS) đã được bảo cảo liên quan tới điếu trị Gemcitabin Chưa
biết được nguyên nhân cùa cảc ảnh hướng nảy Nếu cảc ảnh hưởng nảy tiến triến nên cân
nhắc ngừng điếu trị Gemcitabin. Sử dụng sớm cảc biện phảp chăm sóc hỗ trợ có thể cải thiện
được tinh trạng nảy.
Thân
Các dấu hiện lâm sảng liên quan với hội chứng urê huyết tan mảu (HUS) hiếm kh ợc bảo
cảo ở cảc bệnh nhân dùng Gemcitabin (xem phần 4 8) Nên ngừng dùng Gemcita có
cảc dấu hiệu đầu tiên cùa bằng chửng cho thấy thiếu máu tan huyết do bệnh lý vi mach mảu
như haemoglobin giảm nhanh đổng thời với sự giảm tíếu câu, tăng bilirubin huyết thanh
creatinine huyết thanh, nitrogen urê máu, hoặc LDH. Sự suy thân có thế không hồi phục khi
ngừng điếu trị và có thế yêu cầu thẳm phân mảu.
Khả năng sinh sản
Trong cảc nghiên cưu về khả năng sinh sản Gemcitabin gây giảm sinh tinh trùng ở chuôt đưc
(xem phần 5 3) Vì vậy, nam giới đang bị điều trị với Gemcitabin không được có con trong
khi điếu trị và trong 6 tháng sau khi dừng điều trị và nến xin tư vân liên quan đến việc bảo
quản lạnh tinh trùng trước khi điều trị bới vì điều trị với Gemcitabin có thể gây giảm khả
năng sinh sản (xem phẩn 4.6).
Natri
Gemzar 200mg chứa 3,5 mg (< 1 mmol) natri mỗi ống Nên xem xét điếu nảy với những
5
-lffl-
bệnh nhân đang ăn kiêng muối
4.5 Tương tác với các thuốc khác và cảc dạng tuơng tác khác
Không có nghiên cứu tương tảc cụ thể được thực hiện (xem phần 5.2)
Xa tri
Đồng thời (dùng đồng thời hoặc cảch nhau 5 7 ngảy) - Độc tính liên quan với điều trị đa
phương phảp phụ thuộc vảo nhiều yếu tố khảc nhau, bao gồm liều Gemcitabin, Tần suất sử
dụng, mức độ bức xạ, kỹ thuật dự định xạ trị, mô đich, và thể tích đích. Cảc nghiên cứu tiến
lâm sảng và lâm sảng cho thấy Gemcitabin có hoat tính nhạy cảm với tia xạ. Trong một thử
nghiệm đơn, dùng đồng thời iiếu Gemcitabin 1000 mg/m2 với iiệu phảp xạ trị ở ngực cho
nhĩmg bệnh nhân ung thư phổi không phải tế bảo nhỏ, độc tinh nghiêm trọng đáng kể, và
viêm mảng nhầy đe dọa tính mạng tiềm ẫn, viêm thực quản, và viêm phổi đã được quan sảt
thể đặc biệt ở những bệnh nhân vói thể tích xạ trị lớn [thể tích điều trị trung bình 4,795
cm ]. Cảo nghiên cứu sau đó cho rằng đó có thể là dùng Gemcitabin liều thấp đồng thời cùng
xạ trị với đôc tính có thể dự đoán trước được, như một nghiên cứu pha II với bệnh ung thư
phổi không phải tế bảo nhỏ, áp dụng xạ trị ở ngực với mức 66 Gy đồng thời với sử dụng
Gemcitabin (600 mg/mz, bốn lần) và cisplatin (80 mg/m2 2 lần) trong 6 tuần.
Chế độ điếu trị an toản tối ưu của Gemcitabin với liều trị liệu xạ ta chưa được xảc định ở tất
cả cảc loại ung thư,
Không dùn g đồng thời (cách nhau > 7 ngảy) Dữ liệu phân tích không chỉ ra bất kỳ sự tãng
độc tính nảo khi dùng Gemcitabin nhiều hơn 7 ngảy trước hoặc sau phóng xạ, ngoải phản ứng
phóng xạ. Các dữ liệu cho thấy có thể bắt đầu dùng Gemcitabin sau khi cảc ảnh hướng cấp
tính của phóng xạ đã được phục hổi hoặc ít nhất 1 tuần sau phóng xạ.
Chấn thương do phóng xạ đã được bảo cảo với các mô đích (như viêm thực quản, viêm ruột
kết, và viêm phổi) liên quan đến cả việc dùng đồng thời hoặc không đồng thời với
Gemcitabin.
Những vấn đề khảc ')
Sốt vảng và các vắc xin giảm độc sống khảo không được khuyến cảo do nguy ản t ,
có thể gây chết, bệnh tật, đặc biệt lá ở cảc bệnh nhân bị ức chế miễn dịch.
4.6. Phụ nữ có thai và cho con bú
Man gthai
Không có đầy đủ dữ liệu về việc sử dụng Gemcitabin ở phụ nữ mang thai. Cảc nghiện cứu ở
động vật cho thấy độc tính trên khả năng sinh sản (xem phần 5.3). Dựa trên cảc kết quả từ
nghiên cứu trên đông vật và cơ chế tảc dụng cùa Gemcitabin (xem phần 5.3), không nên sử
dụng hoạt chất nảy trong khi mang thai trừ khi thực sự cần thiết. Nên khuyên phụ nữ không
được mang thai trong khi điếu trị với Gemcitabin và cảnh bảo họ phải xin tư vân thầy thuốc
ngay lập tức nếu điều đó xảy ra
Cho con bú
Không biết được liệu Gemcitabin bải tiết qua sữa mẹ hay không và những tảo dụng có hại đối
với trẻ đang bú lá không thế loại trừ Phải ngừng cho con bú trong khi điều trị với
Gemcitabin.
Khả năng sinh sản
Các nghiên cửu về khả năng sinh sản Gemcitabin gây giảm tinh trùng ở chuột đực (xem phần
5 3). Vì vậy, nam giới đang điếu trị với Gemcitabin không được có con trong khi điếu trị và
6
. nmam
trong 6 thảng sau khi ngừng điếu trị vả nên xin tư vẳn liến quan đến việc bảo quản lạnh tình
trùng trước khi điêu tii bới vi điêu trị với Gemcitabin có thể gây gỉảm khả năng sinh sản.
4.7. Tác động tới khả năng lải xe và sử dụng máy mỏc
Không có nghiên cứu về ảnh hướng đến khả năng lái xe và sử dụng mảy móc được thực hiện.
Tuy nhiên Gemcitabin đã được bảo cảo lả gảy ra trạng thái ngủ gả mức độ từ nhẹ đến trung
binh, đặc biệt sử dụng cùng với rượu. Bệnh nhân không được lải xe hoặc vận hảnh mảy móc
cho đến khi xảc định rõ rầng họ không buồn ngủ.
4.8. Tác dụng không mong muốn
Các phản ưng thuốc có hại được bảo cảo phổ biến nhất liẽn quan đến điếu trị với Gemzar bao
gổm: buồn nôn kèm theo hoặc không kèm theo nôn, tăng men gan (AST/ALT) vả phosphat
kiếm, được bảo các trong khoảng 60% bệnh nhân; protein niệu, huyết niệu được bảo cảo
trong khoảng 50% bệnh nhân; chứng khó thờ được báo cảo trong 10 — 40% bệnh nhân (tỉ lệ
cao nhất ở cảc bệnh nhân ung thư phổi); phát ban da dị ưng xảy ra trong khoảng 25% bệnh
nhân và liên quan đến ngứa trong 10% bệnh nhân.
Tần suất và mức độ nghíêm trọng của cảc phản ứng có hại bị tác động bởi liều dùng, tốc độ
truyền vả khoảng cảch giữa cảc lìều (xem phấn 4 4). Cảc phản ưng có hại trong giới hạn liếu
là giảm tiêu câu bạch câu vả số đếm bạch câu hạt (xem phẳn 4. 2)
Dữ liêu từ thủ nghiêm lâm sảng
Tần suất được định nghĩa như sau: Rất phổ biến (ì1710), phổ biến (giiioo đến <1/10), không
phổ biến (Ẹli'lOOO đến <17100), hiêm (21710000 đên <171000), rât hiêm (<… 0000).
Tần suất và cảc tảc dụng không mong muốn trong ban g dưới đây dựa trén dữ liỀjừ các thu;
nghiệm lâm sảng Trong môi nhòm tân suất, tác dụng không mong muốn đượơtr
thứ tự giảm dẩn mức độ nghiêm trọng
bầVhếo
Nhóm tổ chức cơ thể Nhóm tần suất
Rôi ioạn máu và hệ bạch Rất phô biến _ `
huyết ~ Giảm bạch câu (Giảm bạch câu hạt múc độ 3 = ]9,3
%; Mức độ 4 = 6 %)
Ửc chế tùy xương thuờng nhẹ đến trung bình và ảnh
hướng nhất đến số đếm bạch cẩu hạt trung tính txem
phần 4. 2)
~ Giảm tiếu cầu
~ Thiếu mảu
Phổ biến
~ Sốt giảm bạch cầu
Rất hiếm
~ Giảm tiếu cầu
Rối loạn hệ miễn dịch Rât hiêm
~ Phán ưng phản vệ
Rôi loạn dinh dưỡng và Phò biến
chuyến hóa ~ Chản ăn
M\KI
«" "MQ`p
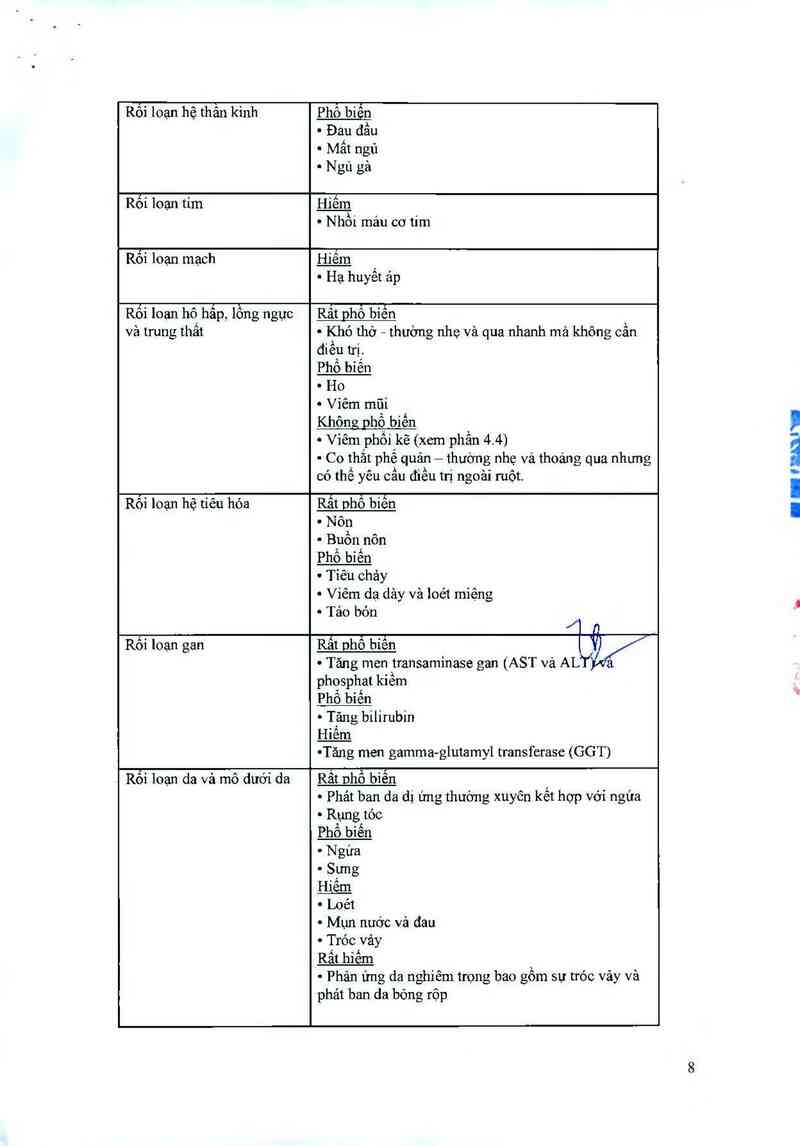
Rối loạn hệ thần kinh Phổ biển
~ Đau đầu
~ Mất ngủ
~ Ngủ gả
Rối loạn tím Hiếm
Ă - . ,
~ th mau cơ tim
Rối loạn mạch
Hiêm _
~ Hạ huyêt ảp
Rối loan hộ hâp, lồng ngực
và trung thât
Rât phổ biến
~ Khó thở — thường nhẹ và qua nhanh mà không cần
điếu trị.
Phổ biến
~ Ho
~ Viêm mũi
Không phổ biến
~ Viêm phổi kẽ (xem phẩn 4.4)
~ Co thắt phế quản — thướng nhẹ vả thoảng qua nhưng
có thế yêu cầu điều trị ngoải ruột.
Rối loạn hệ tiến hóa
@
~ Nôn
~ Buồn nôn
Phổ biến
~ Tỉêu chảy
~ Viêm da dảy vả loét miệng
~ Tảo bón
/ n
Rối loạn gan
Rất ohỗ biển V
~ Tâng men transaminase gan (AST vả AUT< &
phosphat kiếm
Phổ biến
~ Tăng bilirubin
~Tăng men gamma-glutamyl transfcrase (GGT)
Rỏi loạn da và mô dưới da
Rắt nhố biễn
~ Phảt ban da dị ứng thường xuyên kết hợp với ngứa
~ Rụng tóc
Phổ biến
~ Ngứa
~ Sưng
~ Loét
~ Mụn nước vả đau
~ Tróc vảy
Rất hiếm
~ Phản ứng da nghiêm trọng bao gồm sự tróc vảy vả
phảt ban da bỏng rộp
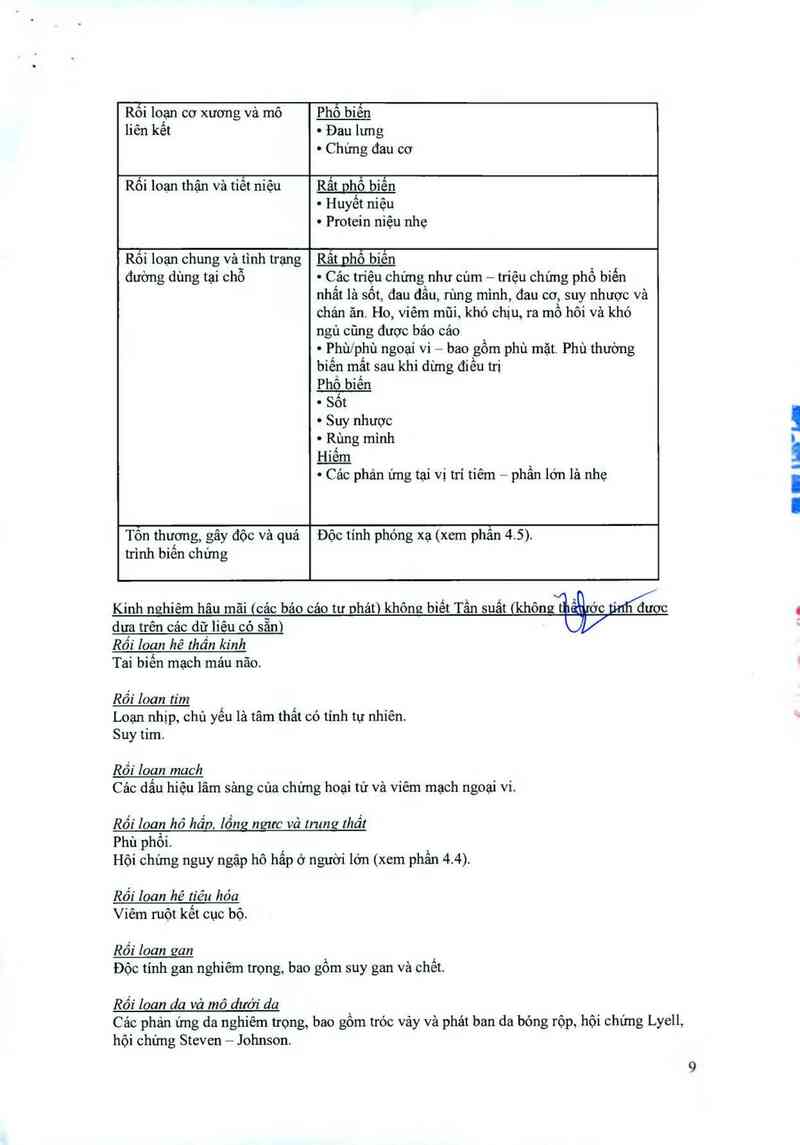
Rối loạn cơ xương vả mô Phổ biến
liên kết ~ Đau lưng
~ Chứng đau cơ
Rối loạn thận và tiết niệu Rất phố biện
~ Huyết niệu
~ Protein niệu nhẹ
Rối loạn chung và tình trạng Rất phổ bíến
đường dùng tại chỗ ~ Cảo triệu chứng như củm — triệu chứng phổ biến
nhất là sốt, đau đầu, rùng mình, đau cơ, suy nhược vả
chản ãn. Ho, viêm mũi, khó chịu, ra mồ hôi và khó
ngủ cũng được báo cáo
~ Phùfphù ngoại vi — bao gổm phù mặt. Phù thường
biến mất sau khi dùng điếu trị
Phổ biến
- Sốt
~ Suy nhược
~ Rùng mình
.Hiế_m
~ Các phản ứng tại vị trí tiêm —- phần lớn là nhẹ
Tôn thượng, gây độc và quả Độc tinh phóng xạ (xem phần 4.5).
trình biến chứng
Kinh n hiêm hâu mãi cảc bảo cáo tư nhảt) không biết Tẩu suất khôn t
dưa trên cảc dữ liêu có sẵn)
Rối loan hê thần kinh
Tai biến mạch máu não.
Rối Ioan tím
Loạn nhịp, chủ yếu là tâm thất có tinh tự nhiên.
Suy tim.
Rối loan mach
Các dấu hiệu lâm sảng của chứng hoại tử và viêm mạch ngoại vi.
Rối Ioan hô hấp. lồng neưc vả trung thất
Phù phôi. \
Hội chứng nguy ngập hô hấp ở người lớn (xem phân 4.4).
Rối loan hé tiêu hóa
Viêm ruột kết cục bộ.
Rối loan gan
Độc tính gan nghiêm trọng, bao gồm suy gan và chết.
Rối loan da và mô dưới da \
Các phản ứng da nghiêm trọng, bao gôm tróc vảy vả phảt ban da bỏng rộp. hôi chứng Lyell,
hội chứng Steven — Johnson.
-IWI.
Rồi“ loan thân và đưòmz niên
Suy thận (xem phân 4.4)
Hội chừng urê mảu tan huyêt (xem phân 4.4).
Tôn thươnQ. ZâV đôc vả auá trình biến cht'mQ
Phản L'mg phóng xạ.
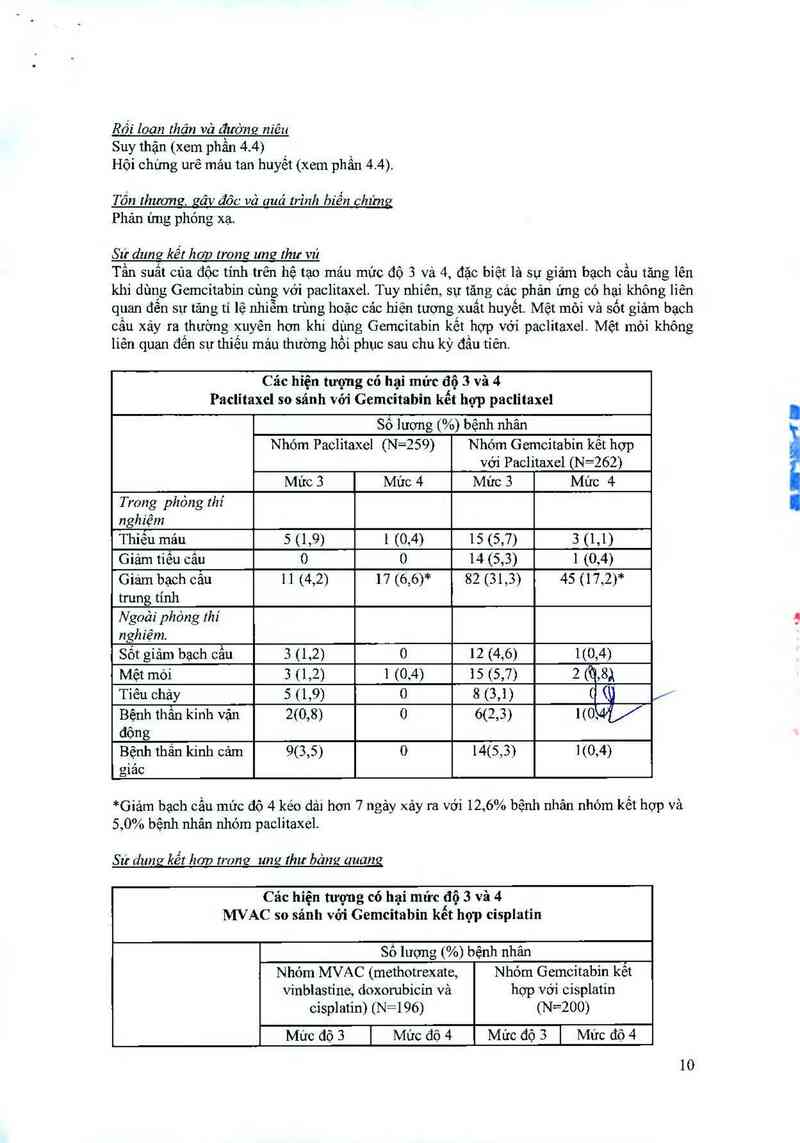
Sư dung kết hop lromz une thư vú
Tần suất của độc tính trên hệ tạo máu mức độ 3 và 4, đặc biệt là sự giảm bạch cẳu tăng lên
khi dùng Gemcitabin cùng với paclitaxel. Tuy nhiên, sự tăng các phản ứng có hại không liên
quan đến sự tăng tỉ lệ nhiễm trùng hoặc CảC hiện tương xuất huyết Mệt mỏi và sốt giảm bạch
câu xảy ra thường xuyên hơn khi dùng Gemcitabin kết hợp với paclitaxel. Mệt mòi không
liên quan đến sự thiếu máu thường hồi phục sau chu kỳ đầu tiên.
Các híện tượng có hại mửc độ 3 và 4
Paclỉtaxel so sánh với Gemcitabin kết hợp paclitaer
Sô lương (%) bệnh nhân
Nhóm Paclitaxel (N=259) Nhóm Gemcitabin kêt hợp
với Paclitaxcl (N=262)
Mức 3 Mức 4 Mức 3 Mức 4
Trong phỏng thí
nghiệm
Thiếu máu 5 (1,9) 1 (0,4) 15 (5,7) 3 (1,1)
Giảm tiếu cẩu o 0 14 (5,3) 1 (0,4)
Giám bạch cầu 11 (4,2) 17 (6,6)* 82 (31,3) 45 (17,2)*
trưng tinh
Ngoài phòng thí
nghỉệm.
Sốt giảm bạch cầu 3 (1,2) 0 12 (4,6) 1(0,4)
Mệt mỏi 3 (1,2) 1 (0,4) 15 (5,7) 2 (0,8)
Tỉêu chảy 5 (1,9) 0 8 (3,1) ( (
Bệnh thần kinh vận 2(0,8) 0 6(2,3) 1(0,
động
Bệnh thần kinh cảm 9(3,5) 0 14(5,3) 1(0,4)
giac
*Giảm bạch cầu mức độ 4 kéo dải hcm 7 ngảy xảy ra với 12,6% bệnh nhân nhóm kết hợp và
5,0% bệnh nhân nhóm paclitaxel.
Sư dung kết hơn trong umr thư bảng auang
Cảc hiện tượng có hại mức độ 3 và 4
MVAC so sánh với Gemcitabin kết hợp cisplatin
Sô lượng (%) bệnh nhân
Nhóm MVAC (mcthotrexatc,
vinblastine, doxorubicin vả
cisplatin) (N=196)
Nhóm Gemcitabin kết
họp với cisplatin
(N=200)
Mức dộ 3 ] Mức độ 4
Mức độ 3 | Mức độ4
10
Trong phòng thí
nghiệm
Thiếu mảu 30(16) 4(2) 47(24) 7(4)
Giảm tiếu cẳu 15(8) 25(13) 57(29) 57(29)
Ngoài phòng thí
nghiệm
Buồn nôn vả nôn 37(19) 3(2) 44(22) O(O)
Tiêu chảy 15(8) 1(1) 6(3) 0(0)
Nhiễm trùng 19(10) 10(5) 4(2) 1(1)
Viêm da dảy 34(18) 8(4) 2(1) 0(0)
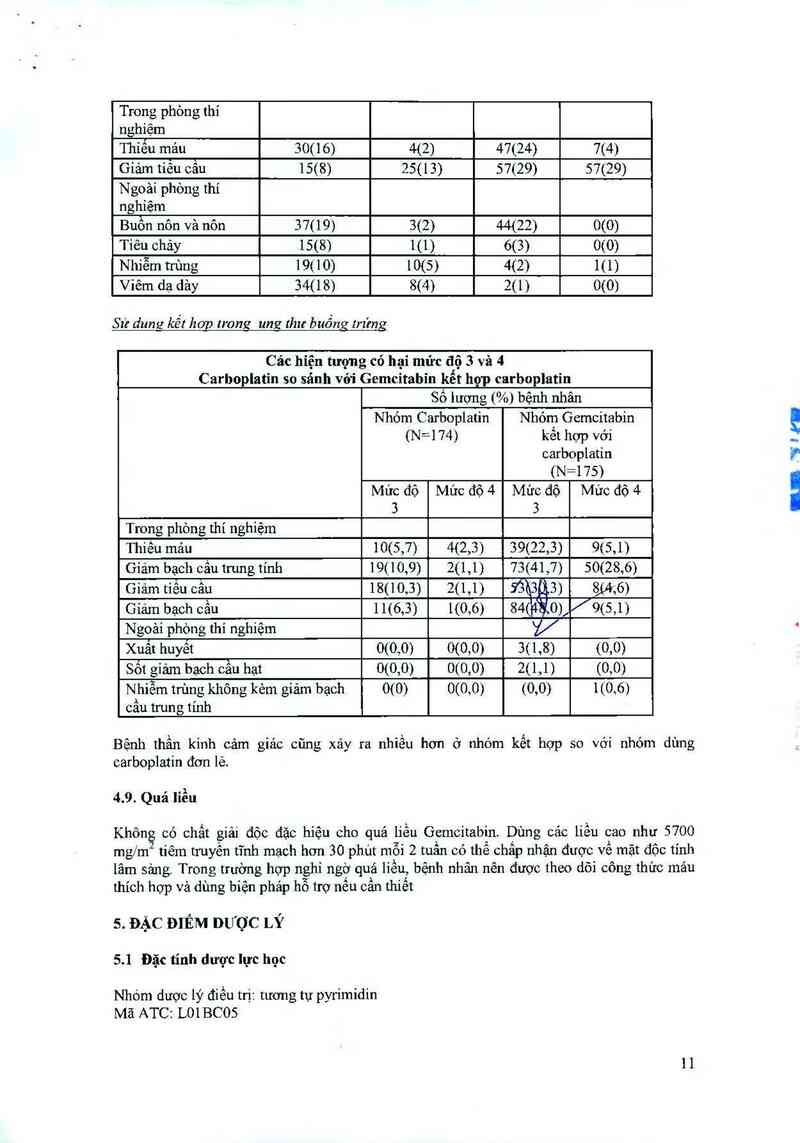
Sư dung kết hơp lrong ung thư buồng trứng
Các hiện tượng có hại mức độ 3 và 4
Carboplatin so sánh với Gemcitabin kết hợp carboplatin
Sổ iượng (%) bệnh nhân
Nhóm Carboplatin Nhỏm Gemcitabin
(N=174) kêt hợp với
carboplatin
(N=175)
Mức độ Mức độ 4 Mức độ Mức độ 4
3 3
Trong phòng thí nghiệm
Thiếu mảu 10(5,7) 4(2,3) 39(22,3) 9(5,1)
Giảm bạch cẳu trung tinh 19(10,9) 2(1,1) 73(41,7) 50(28,6)
Giảm tiếu cầu 18(10,3) 2(1,1) 93t3Ẹ3) g(4,6)
Giảm bạch cầu 11(6,3) 1(0,6) 84(ffl0), /9(5,1)
Ngoài phòng thí nghiệm V
Xuất huyêt 0(0,0) 0(0,0) 3(1,8) (0,0)
Sốt giảm bạch câu hạt 0(0,0) 0(0,0) 2(l,l) (0,0)
Nhiễm trùng không kẻm giảm bạch 0(0) 0(0,0) (0,0) 1(0,6)
cầu trun g tính
Bếnh thần kinh cảm giảc cũng xảy ra nhiếư hơn ở nhóm kết hợp so vởi nhóm dùng
carboplatin đơn lẻ.
4.9. Quả liều
Khôn có chất iải độc đậc hiệu cho quả liếu Gemcitabin. Dùng cảc liếu cao như S700
Ẹ g
mgfm“ tiêm truyền tĩnh mạch hơn 30 phút mỗi 2 tuần có thể chẩp nhận được về mặt độc tính
lâm sảng. Trong trường hợp nghi ngờ quá liếu, bệnh nhân nên được theo dõi công thức mảu
thích hợp và dùng biện phảp hỗ trợ nếu cần thiết
5. ĐẶC ĐIỂM DƯỢC LÝ
5.1 Đặc tính dược lực học
Nhóm dược lý điều trị: tương tự pyrimidin
Mã ATC: L01 BCOS
Il
— ỨlPI
Hoat tính đôc tế bảo trong tế bảo tzốc
Gemcitabin thế hiện tác dụng phân hủy tế bảo đối với cảc tế bảo khối u gốc ở người và loải
gặm nhấm. Tác dụng cùa nó đặc hiệu theo pha như Gemcitabin chủ yếu diệt các tế bảo trải
qua sự tống hợp DNA (pha S) và trong một số trường hợp nhắt định, ngăn chặn sự tiến triến
cùa cảc tế bản tại những điếm tiếp giáp pha Gt/S Trong phòng thí nghiệm, tảc dung phân
giải tế bảo cùa Gemcitabin phụ thuôo vảo cả nống độ và thời gian.
Hoat tinh chống khối n trong cảc mô hinh tiến lâm sảnc.
Trong các mô hình tiền lâm sảng, hoạt tính chống khối u của Gemcitabin là phụ thuộc thòi
biếu. Khi dùng Gemcitabin hảng ngảy, quan sảt thấy ti lệ tử vong cao ở các động vật nhưng
hoạt tính chống khối 11 lại fẳt nhỏ. Tuy nhiên, Gemcitabin thường được dùng mỗi 3 hcặc 4
ngảy, có thể dùng ở các liều không gây chết với hoạt tinh chống khối u đáng kể trên nhiếư
loại khối u ở chuột.
Cơ chế tác dung
Cơ chế tảc dụng và chuyến hóa tế bảo: Gemcitabin (dFdC) là một chất chống chuyến hớn
pyrimidine, được chuyến hóa trong tế bảo bới men nucleoside kinase tạo thảnh diphosphate
(dFdCDP) vả triphosphate (dFdCTP) hoạt tỉnh. Hoạt tinh độc tế bảo của Gemcitabin là do ức
chế tổng hợp DNA qua 2 cơ chế tác dụng bởi dFdCDP vả dFdCTP. Trước hết, dFdCDP ức
chế men ribonucleotide reductase, lả men duy nhất xúc tảc cảc phản ưng tạo ra
deoxynucleoside triphosphates (dCTP) để tổng hợp DNA. Sự ức chế men nảy bới dFdCDP sẽ
iảm gíảm nồng độ deoxynucleoside nói chung, đặc biệt lả dCTP. Thứ hai lả, dFdCTP cạnh
tranh với dCTP để gắn vảo DNA (tự tăng tiếm lực).
Tương tự như vậy, một lượng nhỏ Gemcitabin cũng có thể gắn vảo RNA. Như vặy, nồng độ
nội bảo của dCTP giảm sẽ lảm cho việc gắn dFdCTP vả DNA dễ dảng hơn. DNA polymerase
epsilon không thế loại bỏ Gemcitabin vả sửa chữa được chuỗi DNA đang phát triến Sau khi
Gemcitabin găn vảo DNA, một nucleotide nữa gắn thêm vảo chuỗi DNA đan phảt triến Sau
khi gắn thêm nucleotide nảy, sự tổng hợp DNA thực sự bị ưc chế hoản tồạẫkhóab ếm kết
thúc của chuỗi). Sau khi găn vảo DNA, Gemcitabin thúc đây quá trình híỀj iệ e bảo theo
chương trình định trước, được gọi là “apoptosis”. V
Dữ liêu lâm sảng
Ung lhư bâng cmang
Một nghiên cứu ngẫu nhiên pha 111 trên 405 bệnh nhân với ung thư biếu mô tế bảo tiết niệu di
căn hoặc tiến triến cho thắy không có sự khác nhau giữa 2 nhóm, nhóm dùng
Gemcitabin/cisplatin so sảnh với methotrexate/vìnblastine/adriamycin/cisplatin (MVAC), vế
tỉ lệ sống sót binh quân (12,8 và 14,8 tháng tương ứng, p= 0,547), thời gian tiến triến bệnh
(7, 4 và 7, 6 thảng tương ứng, p= 0,842) và tỉ lệ đáp ứng (49, 4° b và 45,7% tượng ưng, p =
0 ,.512) Tuy nhiên, Sự kết hợp của Gemcitabin với cisplatin đã cho đồ thị độc tinh tốt hơn
MVAC.
Ung lhư tuvển tuỵ
Trong một nghiên cứu ngẫu nhiên pha 111 trên 126 bệnh nhân với ung thư tuyến tựy di cãn
hoặc tiến triển, Gemcitabin cho tỉ lệ đảp ứng lâm sảng cao hơn có ý nghĩa thống kê so với 5—
fluorouxacil (23, 8% và 4,8% tương ứng, p= 0 ,.0022) Ngoài ra, sự kéo dải thời gìan tiến triền
có ý nghĩa thống kê từ 0,9 đến 2, 3 thảng (log- -rank p
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng