












VMINJĐHV M ỉTWJ
NOUJU'JSìHd 03113 811111 ]“lVS
I`ll 1 ĩm
NWJW W lmOd UM'INdOAI
asn Mi nị
²thwìllmĐ
.adoumag
utmm mu…g ri:
›nưutuaịb
'ở
qtenmank
R: Prescmncn Meclĩilt!
GemhopeE
Gemcitabine
tor injection USP
200 mg
L YOPHILIZEO PO WDER
FOR INJECHON
IV USE
Cumt: i vial
SALE UNDER
FILED PRESCRIPTION
MADE IN ARGENTINA
Lân đauffl.ỔlẮỸ
tiuoli-q muưmu cumnositiun
Each vtal mtaim
Gamenahine hyđrochlodde USP
equivalent to Gemcitdinne 200 mg.
Excipienis q.s.
mmge: see caticnt package inscrt
Canatuly mad tre mscrt betom use
lnnmlton. cuntn~tndtcntnn onngu |
aaniústntinn: see pack msert
Ri Ĩìlổc bh Ihnư … GEMMOPE 111) mg Ì
uc dhnỵ ua ph: m.. Trn_vổn t1nh mọch
ẺBK: \“N- On citi llớp 1 lọ
Tìilh phin: Mồt lo chín Gnncifùm
'iytltodllblẵđ USP mvng đuunạ 0th uhm
200mg
Iln quln: Ban quan ở nhiệt Ổ khđng quá ,10'C ,.
N u lảln u_v m un. Dot kỹ hướng dù 11!
đgng tnn'ư khi dửng. ›
Lhi đinh chỏng rhi đmh. cich dung. liẻti đílng
ủ ca'c ihđng tin 11… item nnng tờ hướng dẩn
m cụng ktni thu:
sẻ iỏ sx NSX ›… xcm %… No.”. ~.u ' .
Dntc'. “Enp Dnle“ … bnc bi
s…: mất tại .-\c-hen-lì~u bơi: GLE
ÙFNERIG S A
L`llic 9 Inn McựrOh N’ 59] Puque
nndttstnal Pilli’, Pmufh'll dc Eưenns Aim. Ac-
hen—h-nn
DNNK:
,ncb—fc—
ý,ị›of=Uffciạfn
qtenmanzk
Rx Prescnpthm Meủcme
Eemhopee
Gemcitabine
for injection USP
2110 mg
L vom7uzsn mwosn
FOR muscnon
… use 1
Contem: i vial
SALE UNDER
FILED PRESCRIPTION
MADE IN ARGENTINA
Batch No.
Mtg. Oaie
Exp. Date.
bar code area
Stnre It hmpuatures ml ucmtiu 30’0
IEEP DƯT DF REAEN DF CHILDREN
visa No.:
TM: mlđieinl mui … ueluu'rdy …
undcr mcơical pmchde snd It cau
not »: rupultơ ulthout : nu
placưptinn.
Medcinal pmfflct authsz hy the
Minshy ot man (AN M.AlJ
Certificate N“ 55.470
Manutactmed it
Ghnmn €…qu SA
Cali: 9 hq. Meyer Dks N“ 593
Parqua Inmstiizi Piiar
Provincia oe Suean Ames Amennna
Mmutacmred lu
Glcnmart Phatmaneuticll: thi.
B/2 Mnnaiauuí Chambers
22 Bhutatihan Desa' Road
Mumbai — 400 026. 1nuia
@ Trade Matt
PE
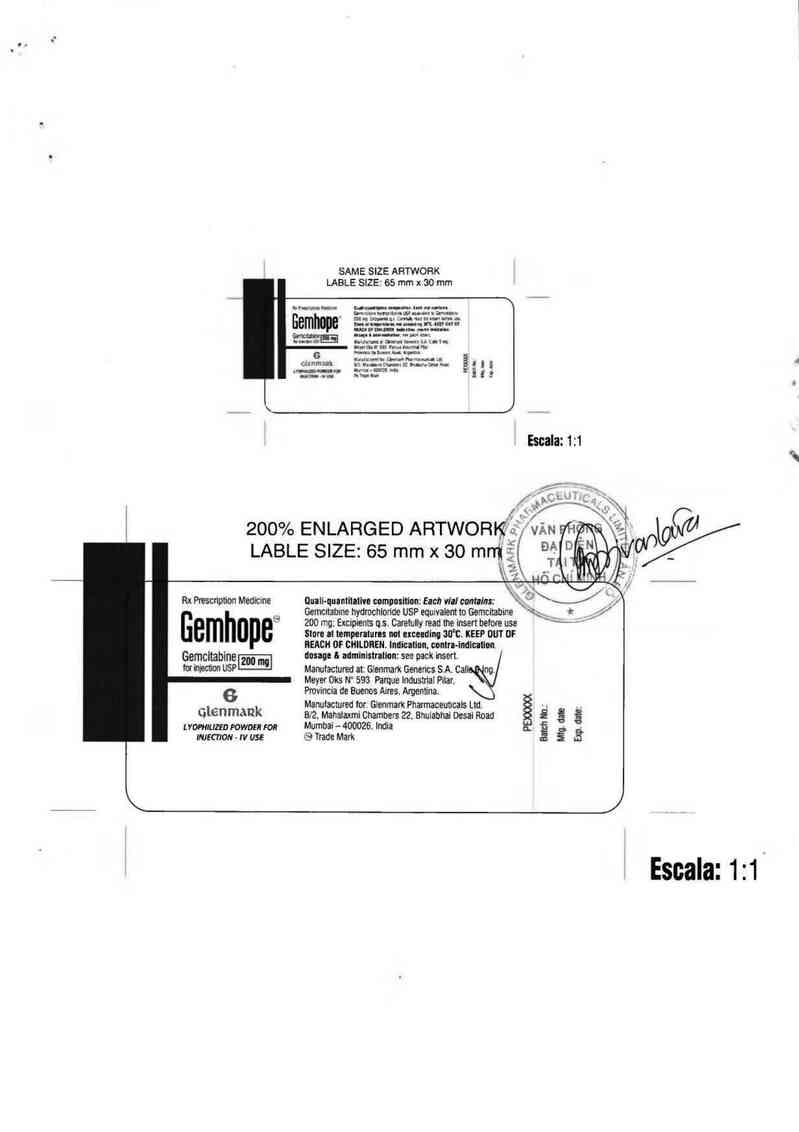
SAME SIZE ARTWORK
LABLE SIZE’ 65 mm x 30 mm
Ve Pmetu Mn:
b…rmnm'kmDunM: :puuz
Muc imounụ :nu mnumwtua
mung…uu-uum; n.nm nnnr
WM
u…ntu IlụdIn na uum-u
mnlmm unnl- —n…
, El mqun… … nt: ut
nuưms wamnũwnxủunsn cang
mu…rm ru… mm: ²11-
6 muut.mm nụmu
t……m u. .'th … …… …
GIENNRX er: UAÌ'nCWi n ….uu … i ] ị
,....nnu m….u-mm i Í I
ư— Ht- Ể'Iva …
zoovo ENLAFiGED ARTWOFWĨỂ"
LABLE SIZE: 65 mm x 30 mntỆ
't%'
\qe.
;,
Rx Prescription Medicine OuaIi-quantitative compnxition: Each via] cunhins: \\“ ,
m Gemcttabtne hydrochloride USP equwaiemto Gemcitabine " \_ t . ở
— 200 mg: Excmients q.s. Careiuiiy read the insert beiore use ` *-~ ~ "
Stnre at temperatttm not ucuding 30°C. KEEP OUT OF
REACH OF CHILDREN. inliicatiun, contra-lndlntiun
Gemcitabine- dosage & lđminiSừlllOllt see pack 'nsert
tot inpcti'on USP Manufactured at: Glenmark Generics S.A. Cai ng.
Meyer Oks N° 593 Pamue Industrial Piiar.
G Provincia de Buenos Atres. Argentina.
Manuiactured tnr; Glenmark Pharmaceuucais Ltd J : ,
qtenmảnk 8/2. Mahalaxmi Chambers 22. Bnulabhaỉ Desai Road i Ẹ ẵ
tvomuzso POWDER «… Mumbai — 400026. lnơia €
mscnon - … use @ Trade Matk ẫ Ể Ê
Escala: 1:1 '
l`
Rx Thuốc bán theo đơn
GEMHOPE
Gemcitabin
THÀNH PHÀN
Gemhope 200mg: Mỗi lọ chứa gemcitabin hydrochlorid tương đương gemcitabin 200 mg.
Sau khi hoản nguyên, dung dịch chửa 38 mglml gemcitabin.
T á dược: Mannitol, natri acetat khan, acid hydrochloric (dễ điều chinh pH), natri hydroxid (để điếu chinh
pH).
Mỗi lọ chứa 3,5 mg (< 1 mmol) natri.
DẠNG BÀO CHẾ
Bột đông khô pha dung dịch tiếm truyền tĩnh mạch.
Bột hoặc bảnh thuốc mảu trắng đến trắng ngả.
cni ĐỊNH ĐIỀU TRỊ
Gemcitabin được chỉ định kết hợp với cisplatin đề điếu trị ung thư bảng quang tiến triển tại chỗ hoặc di
căn.
Gemcitabin được chỉ định để điếu trị ung thư biếu mô tuyến tụy tiến triến tại chỗ hoặc di căn.
Gemcitabin kết hợp với cisplatin được chỉ định điếu trị bước một (first-line) cho bệnh nhân ung thư phổi
không phải tế bảo nhỏ (NSCLC) tiến triến tại chỗ hoặc di căn. Gemcitabin đơn trị liệu có thế được xem
xét ở những bệnh nhân lớn tuồi hoặc những người có tình trạng hoạt động loại 2.
Gemcitabin kết hợp với carboplatin được chỉ định để điều trị ung thư biếu mô buồng trứng tiến triến tại
chỗ hoặc di căn ở những bệnh nhân có bệnh tái phải sau một khoảng thời gian không tải phát ít nhất 6
tháng sau khi điếu tri bước một bằng thuốc có platin.
Gemcitabin kết hợp với paclitaxel được chỉ định để điều trị bệnh nhân unử vú tái phát tại chỗ không
thế phẫu thuật được hoặc ung thư vú di căn đã bị tái phảt sau khi hóa trị bổ tr ân bổ trợ. Hóa trị trước đó
phải bao gồm anthracyclin, trừ khi có chống chỉ định lâm sảng.
LIÊU DÙNG VÀ CÁCH DÙNG
Gemcitabin chỉ nên được bác sĩ có chuyên môn về hóa trị liệu chống ung thư kê đơn.
Liều lương khuvến cáo:
Ung thư Qảne guang
Sử dụng kết hợp
Liều khuyến cáo gemcitabin là 1000 mg/mz, tiêm truyền 30 phủt. Nên dùng vảo ngảy 1, 8 và 15 cùa mỗi
chu kỳ 28 ngảy, kết hợp với cisplatin. Cisplatin được khuyến cảo sử dụng một Iiếu 70 ngm² vảo ngảy 1
sau gemcitabin h0ặc ngảy 2 cùa mỗi chu kỳ 28 ngảy. Chu kỳ 4 tuần nảy sau đó được lặp lại. Có thế ảp
dụng giảm liếu dùng đối với mỗi chu kỳ hoặc trong một chu kỳ dựa trên mức độ độc tính mả bệnh nhân
1/17
'~'Ắ)
trải qua.
Ung thư !uvển tuv
Liều gemcitabin khuyến cáo là 1000 mg/m², truyền tĩnh mạch trong 30 phủt. Cần lặp lại một lân hảng
tuần cho đến tận 7 tuẫn kế tiếp sau đó nghỉ một tuần. Cảo chu kỳ tiếp theo cần bao gôm tiêm một lần hảng
tuần trong 3 tuần liên tiếp trong mỗi 4 tuần. Có thế áp dụng giâm lỉếu dùng đôi vởi mỗi chu kỳ hoặc trong
một chu kỳ dựa trên mức độ độc tinh mả bệnh nhân trải qua.
Umz thư QhỔỈ khỏn2 tế bảo nhỏ
Đơn trị liệu
Liều gemcitabin khuyến cáo lả 1000 mg/m², truyền tĩnh mạch trong 50 phút. Cần lập đi lặp lại một lân
hảng tuần trong 3 tuần, sau đó nghỉ 1 tuần. Chu kỳ 4 tuần nảy sau đó được lặp lại. Có thế ảp dụng giảm
liều dùng đối với mỗi chu kỳ hoặc trong một chu kỳ dựa trên mức độ độc tính mà bệnh nhân trải qua.
Sử dụng kết hợp
Liều gemcitabin khuyến cảo là 1250 mglm² diện tích bề mặt cơ thể truyền tĩnh mạch trong 30 phủt vảo
ngảy 1 vả ngảy 8 của chu kỳ đỉếu trị (21 ngảy). Có thế ảp dụng giảm liếu dùng đối với mỗi chu kỳ hoặc
trong một chu kỳ dựa trên mức độ độc tính mà bệnh nhân trải qua. _
Cispiatin được sử dụng ở liêu trong khoảng 75—100 mglm2 một lần trong môi 3 tuần.
Ung lhư vú
Sử dụng kết hợp
Khuyến cáo sử dụng kết hợp gemcitabin với paclitaxel. Truyền tĩnh mạch paciitaxel (175 mglml) vảo
ngảy 1 trong khoảng 3 giờ, sau đó truyền tĩnh mạch gemcitabin (1250 mg/mz) trong 30 phủt vảo ngảy 1
và 8 trong mỗi chu kỳ 21 ngảy. Có thế áp dụng giảm liều dùng đối với mỗi chu kỳ hoặc trong một chu kỳ
dựa trên mức độ độc tính mà bệnh nhân trải qua. Bệnh nhân cẩn phải có số lượng bạch cầu hạt tuyệt đối it
nhắt [ả 1500 (x 10°11)ttước khi bắt đầu kết hợp gemcitabin vả paclitaxel.
Ung thư buồng i'rủ'ng
Sử dụng kết hợp
Khuyến cảo sử dụng kết hợp gemcitabin với carboplatin. Truyến tĩnh mạch gemcitabin 1000 mg/m2 trong
30 phút vảo ngảy ] và 8 cùa mỗi chu kỳ 21 ngảy. Sau khi sử dụng gemcitabin, carboplatin cần phải được
truyền vảo ngảy 1 để đạt diện tích dưới đường cong (AUC) lả 4,0 mglmi.ủittco thế ảp dụng giảm Iiếu
dùng đối vởi mỗi chu kỳ hoặc trong một chu kỳ dựa trên mửc độ độc tính hìâ~Ĩầệảh nhân trải qua.
Giảm sải đôc tính vả điếu chinh liếu theo đôc tính
Điều chinh liều do đôc lính nhi huvểl hoc
Cần tiến hảnh kiếm tra sức khỏe định kỳ và kiếm tra chức năng gan thận nhằm phát hiện độc tính phí
huyết học. Có thế ảp dụng giảm liếu dùng đối với mỗi chu kỳ hoặc trong một chu kỳ dựa trên mức độ độc
tính mà bệnh nhân trải qua. Nói chung, đối với độc tính phí huyết học nặng (độ 3 hoặc 4), trừ buồn
nôn/nôn, iiệu pháp gemcitabin nên được loại bỏ hoặc gỉảm tùy thuộc vảo quyết định của bác sĩ điếu trị.
Cần ngừng dùng gemcitabin cho đến khi dộc tính đã được xử lý, theo ý kiến của bảo sĩ.
Đối với việc điếu chinh liếu cisp1atin, carboplatin, vả paclỉtaxel trong liệu pháp phối hợp, vui lòng tham
khảo thông tin sân phẩm tương ứng.
Điều chinh liều do đóc tính huvết hoc
2/17
\»
ỈỈ|OỀ.AẸ2
Bắt đẫu một chu kỳ
Đối với mọi chỉ định, cẳn theo dõi bệnh nhân trước mỗi liếu về số lượng tiếu cằu và bạch cầu hạt. Bệnh
nhân cần có số lượng bạch cầu hạt tuyệt đối ít nhất là 1500 (x 106/1) vả số lượng tiểu cầu [ả 100.000 (x
10611) trưởc khi bắt đẫu một chu kỳ.
Trong một chu kỳ
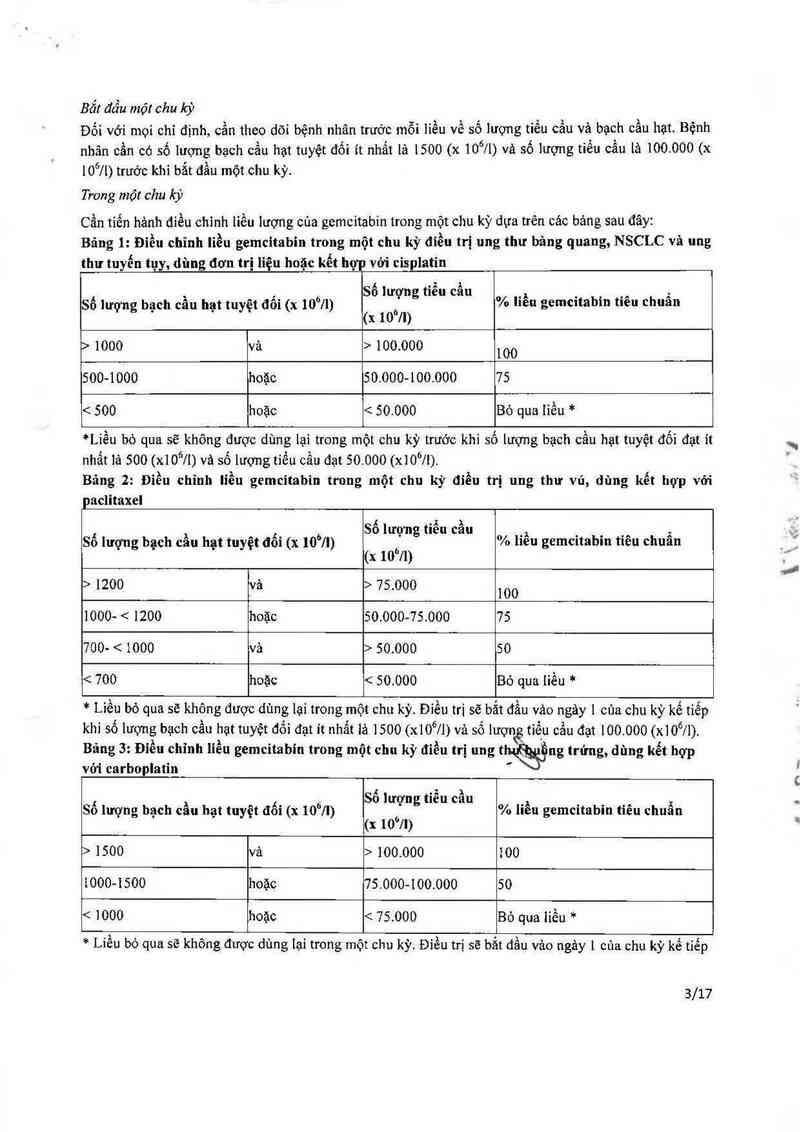
Cần tiến hảnh điều chinh liếu lượng của gemcitabin trong một chu kỳ dựa trên các bảng sau đây:
Bảng 1: Điều chĩnh liều gemcitabin trong một chu kỳ điều trị ung thư bảng quang, NSCLC và ung
thư tuyến tụy, đùng đơn trị lỉệu hoặc kết hợp vởi cisplatin
, , Số lượng tiến cẩu _, _ _ _ ,
Số lượng bạch cau hạt tuyệt đoi (x 10°]1) ủ % hen gemutahtn tieu chuan
(x 10 II)
> 1000 vả > 100.000 100
500-1000 hoặc 50.00 0-1 00.000 75
< 500 hoặc < 50.000 Bỏ qua Iìếu *
*Liếu bỏ qua sẽ không được dùng lại trong một chu kỳ trước khi số lượng bạch cầu hạt tuyệt đối đạt ít
nhẩt 1ả 500(x10611) vả số lượng tiếu cẩu đạt 50.000 (xiO°Ji).
Bảng 2: Điếu chĩnh liều gemcitabin trong một chu kỳ điều trị ung thư vú, dùng kết hợp vởi
paclitaxel
, , , 6 Số lưựng tiễu cầu _, _ _ __ ,
So lượng bạch cau hạt tuyệt đoi (x 10 /I) % lieu gemcttabm tieu chuan
(x 10°11)
> 1200 va > 75.000 100
1000- < 1200 hoặc 50.000-75.000 75
700— < 1000 và > 50.000 50
< 700 hoặc < 50.000 Bỏ qua liều *
* Liều bỏ qua sẽ không được dùng iại trong một chu kỳ. Điếu tti sẽ bắt đẩu vảo ngây 1 của chu kỳ kế tiếp
khi số lượng bạch cầu hạt tuyệt đối đạt it nhất 1ả 1500 (x106/1) và số lượnẻ tiếu cằn đạt 100.000 (x10611).
Bảng 3: Điều chỉnh liều gemcitabin trong một chu kỳ điều trị nng thửng trứng, dùng kết hợp
với carboplatin "
, , Ả Số lượng tiến cầu ,, _ _ ,
So lượng bạch cau hạt tuyệt đoi (x 10°/1) % hen gemcitabin tieu chuan
(x 10'71)
> 1500 và > 100.000 100
i000-1500 hoặc 75.000-100.000 50
< 1000 hoặc < 75.000 Bỏ qua 1iếu *
* Liễu bỏ qua sẽ không được dùng 1ại trong một chu kỳ. Điếu trị sẽ bắt đầu vảo ngảy 1 cún chu kỳ kế tiếp
3/17
khi số lượng bạch cằn hạt tuyệt đối đạt it nhất 1ả 1500 (x106/1) vả số lượng tiến cằn đạt 100.000 (x106/1).
Điều chỉnh Iiều dùng do đóc tính huvết hoc trong các chu ki`J kế tiếp. đối vởi moi chí đinh
Liễu gemcitabin cần được giảm đến 75% iiếu khởi đầu của chu kỳ đầu, trong trường hợp có cảc độc
tính huyết học sau đây:
' Số iuợng bạch cẩu hạt tuyệt đối < 500 X 10671 trong hơn 5 ngảy
' Số lượng bạch cầu hạt tuyệt đối < 100 x 106/1 trong hơn 3 ngảy
~ Sốt giảm bạch cầu trung tính
. Tiếu cầu < 25.000 x 10°Ji
' Trì hoãn chu kỳ hơn 1 tuần do độc tinh
Cách dùng
Gemcitabin dung nạp tốt trong quá trình truyền vả có thể được tiêm lưu động. Nếu tinh trạng thoảt mạch
xảy ra, thường việc truyền phải được chấm dứt ngay lập tức và bắt đầu lại ở mạch máu khác. Bệnh nhân
cần được theo dõi cẩn thận sau khi truyền.
Đế được hưởng dẫn về cách hoản nguyên xem phần T hận trọng đặc biệt khi pha.
Các đối tượng đặc biệt
Bẻnh nhân bi suv thân hoãc Qan
Gemcitabin nên được sử dụng thận trọng ở bệnh nhân suy gan hoặc suy thận do không có đủ thông tin từ
cảc nghiên cửu 1âm sảng để cho phép khuyến cáo liếu rõ rảng cho cảc đổi tượng bệnh nhân nảy (xem
phần Cánh báo vả thận trọng đặc biệt khi sử dụng và Đặc tính dược động học).
Người cao Iuối f> 65 tuốiỉ
Gemcitabin được chứng mỉnh là dung nạp tốt ở bệnh nhân trên 65 tuổi. Không có bằng chứng cho thấy
rằng việc điều chỉnh 1iếu, ngoải việc điếu chinh được khuyến cảo cho tất cả các bệnh nhân, là cần thiết ở
người cao tuồỉ (xem phần Đặc tính dược động học).
Bẻnh nhi [< 18 tuồiị
Gemcitabin không được khuyến cảo dùng cho trẻ em dưới 18 tuối do không đủ dữ liệu về độ an toản vả.
hiệu quả.
CHỐNG CHỈ ĐỊNH
- Quả mẫn cảm với gemcitabin hoặc các tá dược
- Đang cho con bú (xem phần Khả năng sinh sản, thai kỳ vã cho con bủ).
CẨNH BÁO VÀ THẶN TRỌNG ĐẶC BIỆT KHI SỬ DỤNG
Kéo dải thời gian truyền vả tăng tần suất dùng thuốc được chứng minh lả 1ảm tăng độc tinh.
Đôc tinh trên hê huÉt hoc
Gemcitabin có thể gây ức chế chức năng tùy xương với biểu hiện giâm bạch cầu, giảm tiểu cầu vả thiếu
mảu.
Bệnh nhãn dùng gemcitabin nên được theo dỏi trước mỗi 1iếu sử dụng v` ố ịượng tiều cầu, bạch cầu vả
bạch cầu hạt. Việc tạm ngừng hoặc điếu chinh điếu trị cần được xem ' hỉ phảt hiện sự ừc chế tùy
4/17
xương do thuốc (xem phần Liều dùng vả cách dùng). Tuy nhiến, tinh trạng ức chế tủy khá ngắn và thường
không dưa đến việc giảm liếu và hiếm khi ngừng thuốc.
Lượng tế bảo máu ngoại bỉên có thể tiếp tục suy giảm sau khi ngừng dùng gemcitabin. Ở những bệnh
nhân bị suy giảm chức năng tủy xương, việc điếu trị cần được bắt đầu một cảoh thận trỌng. Củng như với
liệu phảp gây độc tế bảo khảo, nguy cơ ức chế tùy xương tích lũy phải dược xem xét khi điếu trị sử dụng
gemcitabin được tiến hảnh cùng với hớa trị liệu khảc.
Suv gan và suv thân
Sử dụng gemcitabin ở những bệnh nhân có di căn gan đồng thời hoặc có tiến sử viêm gan, nghiện rượu
hoặc xơ gan có thể dẫn đến bộc phảt của suy gan tiếm ẩn.
Xét nghiệm chức năng thận vả gan (bao gồm cả xét nghiệm virus học) cẩn được thực hiện định kỳ.
Gemcitabin nên được sử dụng thận trọng ở những bệnh nhân bị suy giảm chức năng gan hoặc thận khi
không có đủ thông tin từ các nghiên cứu lâm sảng để cho phép khuyến cáo liếu rõ rảng cho các đối tượng
bệnh nhân nảy (xem phần Liễu dùng vả cách dùng).
Xa tri đồng thời
Xạ trị đồng thời (đổng thời hoặc cảoh nhau 57 ngảy): Độc tính đã được báo cảo (đế có thông tin chi tỉết
và khuyến cáo sử dụng, xem phẩn Tương tớc với cảc thuốc khác vả các dạng tương tăc khác).
Chùng ngừa sống
Vắc xỉn bệnh sốt vâng vả cảc vắc xỉn sống giảm độc lực khảc không được khuyến cáo ở những bệnh nhân
được đỉếu trị bằng gemcitabin (xem phần Tương tác với các thuốc khác và các dạng lương tác khác).
Hôi chứng bênh lv não hổi ohuc sau đó
Đã có bảo cảo về hội chứng bệnh lý não hồi phục sau đó (PRES) vởi cảc hậu quả nghiêm trọng ở những
bệnh nhân sử đụng gemcitabin đơn trị liệu hoặc kết họp với các thuốc hóa trị liệu khảo. Chứng tăng huyết
áp cẳp tính và co giật đă được báo cáo ở hầu hết bệnh nhân sử đụng gemcitabin mắc hội chứng PRES,
nhưng cũng có thế có cảc triệu chứng khác như đau đầu, hôn mẽ, lù lẫn vả mù. Chấn đoản được xác nhận
một cảch tối ưu bằng cảch chụp cộng hưởng từ (MRI). PRES thông thường được hồi phục bằng biện phảp
hỗ trợ thich hợp. Nên ngưng dùng gemcitabin vĩnh viễn vả tiến hảnh biện phảp hỗ trợ, bao gồm cả kiểm
soát huyết ảp vả đỉều trị chống co giật, nếu PRES phát triến trong quá trinh điếu trị.
Bếnh tim mach
Do nguy cơ gây rối loạn tim vả/hoặc mạch mảu khi dùng gemcitabin, đặc biệt cần thận trọng với bệnh
nhân có tiến sử biến cố tim mạch.
Hôi chừng rò rỉ mao mach
Hội chứng rò rỉ mao mạch đã được bảo cảo trên nhũng bệnh nhân sử dụng gemcitabin đơn trị liệu hoặc
kết hợp vởi thuốc hóa trị khác (xem phần Tác dụng khóng mong muốn). Thường là có thế điếu trị được
tình trạng nảy nếu sớm nhận ra và điếu trị một cách thích hợp, tuy nhiên vẫn có những trường hợp tử
vong được bảo cáo. Tình trạng liên quan đến việc tăng tính thẩm mao mạch toảnt ” mã trong quá trình
đó chất lòng và các protein từ không gỉan nội mạch bị rò rỉ vảo mô kẽ mao mạch.Gitề đặc điếm lâm sảng
bao gồm phù toản thân, tăng cân, albumỉn trong máu thẩp, hạ huyết ảp nghiếm trỌng, suy thận cấp và
5/17
chứng phù phổi. Nên ngưng sử dụng gemcitabin và thực hiện biện pháp hỗ trợ nếu như hội chứng rò rỉ
mao mạch phát triến trong quá trình điếu trị. Hội chứng rò rỉ mao mạch có thể xảy ra trong cảc chu kỳ sau
vả trong y văn có liên quan đến hội chứng suy hô hắp người lớn.
Phổi
Ảnh hưởng đến phồi, đôi khi nghiêm trọng (như chứng phù phồi, viêm phồi mô kẽ hoặc hội chứng suy hô
hấp người lớn (ARDS)) đã được báo cảo có liến quan đến liệu pháp gemcitabin. Nếu ảnh hưởng như vậy
phảt triền, cần xem xẻt tỉến hănh ngưng liệu pháp sử dụng gemcitabin. Sởm đùng biện pháp điếu trị hỗ trợ
có thể giúp cải thỉện tinh trạng nảy.
@
Hội chửng tăng urê máu lản huyết
Những phảt hiện lâm sảng cùng với hội chứng tãng urê mảu tản huyết (HUS) hiếm khi được bảo cảo (dữ
liệu sau khi lưu hânh thị trường) ở những bệnh nhân sử dụng gemcitabin (xem phần Tác dụng không
mong muốn). HUS là chứng rối loạn có tiếm năng đe dọa tính mạng. Nên ngưng sử dụng gemcitabin nếu
xuất hiện những dấu hiệu đầu tiên cúa bất kỳ bằng chứng thiếu mảu tan huyết bệnh mao mạch, như giảm
nhanh hemoglobin vởi giảm tiểu cẳu đồng thời, tảng bilirubin huyết thanh, creatinin huyết thanh, nitơ nrê
mảu, hoảc LDH. Suy thận có thế không hồi phục khi ngừng điếu trị vả có thế phải lọc máu.
Khả năng sinh sản
Trong các nghỉên cứu về khả năng sinh sản, sử dụng gemcitabin gây giảm sinh tinh ở chưột đực (xem
phần Dữ liệu an toc`… liền lâm sảng). Vì vậy, nam gỉới được điếu trị bằng gemcitabin được khuyến cảo
không nến trở thảnh người bố trong suốt thời gian điều trị vả cho đến 6 tháng sau khi điếu trị và cần tìm
hỉếu thêm về kỹ thuật bảo quản lạnh tinh trùng truớc khi điếu trị vì khả năng gây vô sinh do điếu trị với
gemcitabin (xem phẫn Khả năng sinh sản, thai kỳ vả cho con bú).
Natri
GEMHOPE 200mg chứa 3,5 mg (<1 mmol) natri mỗi lọ, tức là về cơ bản, không chứa natri.
TƯỜNG TÁC THUỐC VÀ CÁC DẠNG TƯỚNG TÁC KHÁC
Không có nghiên cứu tương tảc cụ thể nảo được tiến hảnh (xem phần Đặc zính dược động hợc).
Đồng thời (sử dụng cùng nhau hoặc cảch nhau 57 ngảy) - Độc tính liên quan đến liệu phảp đa phương
thức nảy phụ thuộc vảo nhiếư yếu tố khác nhau, bao gồm liều gemcitabin, tẩn suất dùng gemcitabin, liễu
bức xạ, kỹ thuật lập kế hoạch xạ trị, mô đích, và thế tich mục tiêu. Cảo nghiên cứu tiến lâm sảng và lâm
sảng đã cho thẩy gemcitabin có hoạt tính mẫn cảm bức xạ. Trong một thử nghiệm riêng biệt, khi liếu 1000
mg/m2 gemcitabin được dùng đồng thời cho đến 6 tuần liến tiếp vởi liệu pháp xa trị vùng ngục cho những
bệnh nhân ung thư phối không phải tế bảo nhò, đã quan sát thấy đôc tính đáng kể dạng nặng, và viếm
niêm mạc có tiếm nãng đe dọa tính mạng, đặc biệt là viêm thực quản, vả viêm phổi, cụ thể ở những bệnh
nhân nhân tiếp nhận 1ượng lớn xạ trị [trung vị thế tich điều trị 4795 cm3]. Cảo nghiên cứu được thực hiện
sạụ năy đã cho thấy rằng có thể dùng gemcitabin iiều thấp hơn vởi xạ trị đổng thời v " đhc tính đự kiến,
chắng hạn như một nghiến cứu giai đoạn 11 trong ung thư phối không phải tế bảo nh i mả Iiếu xạ trị
vùng ngực của 66 Gy đã được áp dụng đồng thời với dùng gemcitabin (600 mglml, gấp bốn lần) và
cisplatin (SO mglm², gắp hai lẩn) trong 6 tuần. Phác đồ tối ưu cho việc sử dụng gemcitabin an toản với cảc
6/17
IA' r'~-. '
lỉếu xạ trị vẫn chưa dược xảc định đối với tất cả các dạng khối u.
Không đồng thời (sử dụng cảch nhau › 7 ngảy) — Phân tich dữ liệu không cho thấy bẫt kỳ độc tính tãng
cường nảo khi dùng gemcitabin hơn 7 ngảy trước hoặc sau xạ trị, ngoại trừ khả nãng hủy bỏ xạ trị. Dữ
liệu cho thẳy có thể bắt đẩu sử dụng gemcitabin sau khi tảc dụng cấp cùa xạ trị đã được xử lý hoặc ít nhắt
là một tuần sau khi xạ trị.
Tốn thương xạ trị đã dược báo cáo trên các mô đích (ví dụ, viêm thực quản, viêm đại trảng, và viêm phồi)
liên quan đến việc sử dụng đổng thời và không đổng thời gemcitabin.
_1ị_IỆg
Vắc xin bệnh sốt vảng vả vắc xin sống giảm độc lực khảo không được khuyến cảo do có nguy cơ mắc
bệnh toản thân, có thể gây tử vong, đặc biệt ở những bệnh nhân suy giảm miễn dịch.
KHẢ NĂNG SINH SẢN, THAI KỸ VÀ CHO CON BỦ
Thai kỳ
Không có số liệu đầy đủ từ việc sử dụng gemcitabin ở phụ nữ mang thai. Cảo nghỉên cưu trên động vật đã
cho thẩy độc tỉnh trên hệ sinh sản (xem phần Dữ liệu an Ioản tiền lâm sảng). Dựa trên kết quả từ cảc
nghiến cứu từ động vật và cơ chế tảc dụng của gemcitabin, chẳt nây không nên được sử dụng trong quả
trinh mang thai trừ khi thực sự cần thiết. Phụ nữ được khuyên không nên có thai trong khi điếu trị vởi
gemcitabin và cảnh báo nên đi khám bảo sĩ ngay lập tức, nếu có thai.
Cho con bú
Hiện chưa rõ lỉệu gemcitabin có được bải tiết vảo sữa mẹ không, và không thế Ioại trứ tác dụng phụ trên
trẻ bú mẹ. Phải ngưng cho con bú trong khi sử dụng gemcitabin.
Khả nãnc sinh sản
Trong cảc nghiên cứu về khả năng sinh sản, sử dụng gemcitabin gây giảm sinh tinh ở chuột đực (xem
phần Dữ liệu an toản tiền lâm sảng). Vì vậy, nam giới điều trị bằng gemcitabin được khuyến cảo không
nên trở thảnh người bố trong suốt thời gian đíếu trị vả cho đến 6 tháng sau khi điều trị vả cẳn tim hiều
thếm về kỹ thuật bảo quản lạnh tinh trùng trước khi điều trị vi khả năng gãy vô sinh do điếu trị với
gemcitabin.
ẢNH HƯỞNG LÊN KHẢ NĂNG LÁI XE VÀ VẶN HÀNH MÁY
Không có nghỉên cửu về ảnh hưởng đến khả năng iái xe và vận hảnh mảy. Tuy nhiên, gemcitabin được
bảo cảo ia gây buồn ngủ mức độ nhẹ đến vừa phải, đặc biệt lả khi kết hợp với uống rượu. Bệnh nhân được
khuyến cáo không lái xe hay vận hảnh mảy móc cho đến khi thấy rằng họ không bị mơ mảng.
TÁC DỤNG KHÔNG MONG MUÔN
Các phản ứng có hại phổ biến nhất cùa thuốc được bảo cảo liến quan đến điều trị sử dụng gemcitabin bao
gồm: buồn nôn, có hoặc không có nôn ra, tăng men gan (AST/ALT) vả phosphatase kiếm, được bảo cảo ở
khoảng 60% bệnh nhân; protein niệu vả đải ra mảu được bảo cảo ở khoảng 50% bệnh nhân; khó thở đuợc
báo cảo ở 10-40% bệnh nhân (tỷ lệ mắc cao nhắt ở những bệnh nhân ung thư phối); phảt ban da đị ứng
xảy ra ở khoảng 25% bệnh nhân và có líên quan với ngứa ngáy ở 10% bệnh nhân.
Tần suất và mức độ nặng của các phản ứng bất 1ợi bị ảnh hưởng bởi Iiểu lượng, tổ “ iiẽm truyền và
khoảng cách giữa các Iiếu (xem phẩn Cảnh bảo vả zhận Irọng đặc biệt khi sử dụng).`Cầc phản ứng bắt lợi
giới hạn liếu là giảm tỉếu cẩu, bạch cầu và bạch cẩu hạt (xem phần Liều dùng vả cách dùng).
7]17
Dị liêu thủ nghiêm lâm sản
Tần suất được xác định như sau: Rất phổ biến (zillO), Phổ biến (217100 đến <1710), Không phổ biến
(21/1000 đến <1/100),H1ếm gặp (21710000 đến <1/1000), Rất hiếm gặp (<1/10000).
Bảng cảc tác dụng không mong muốn vả tần suất dưới đây dựa trên dữ liệu từ cảc thử nghiệm lâm sâng.
Trong mỗi nhóm tản suất, cảc tác dụng không mong muốn được trình bảy theo thứ tự mức độ nặng giâm
dần.
Bâng 4: Tủc dụnLkhông mong muốn
Nhóm cơ quan hệ thống
Phân nhóm tần suất
Rối loạn hệ bạch huyết
và máu
Rẫ! phố bìến
' Giảm bạch cầu (Giảm bạch cẩu trung tinh độ 3 = 19,3 %; độ 4 = 6 %).
' Ức chế tủy xương thường mức độ nhẹ đến trung binh vả chủ yểu ảnh
hưởng đến số lượng bạch cầu hạt (xem phần Liều dùng vả cảoh dùng và
Cảnh báo và thận trọng đặc biệt khi sử dụng)
~ Giảm tỉếu cầu
› Thỉểu máu
Phố biển
' Sốt giảm bạch cầu trung tính
Rất hiếm gặp
' Tăng tiếu cầu
Rối Ioạn hệ miễn dịch
Rất hiếm gặp
' Phản ứng phản vệ
Rối loạn chuyến hóa và
dinh dưỡng
Phổ biến
' Chứng biếng ăn
Các rối ioạn hệ thần kinh
Phổ biến
' Nhức đầu
' Mất ngủ
~ Buồn ngủ
Khôngphồ biến
' Tai biến mạch mảu não
Rất hiếm gặp
' Hội chứng bệnh não phía sau có hồi phục (xem phần Cảnh b ' ”n
trọng đặc biệt khi sử dụng)
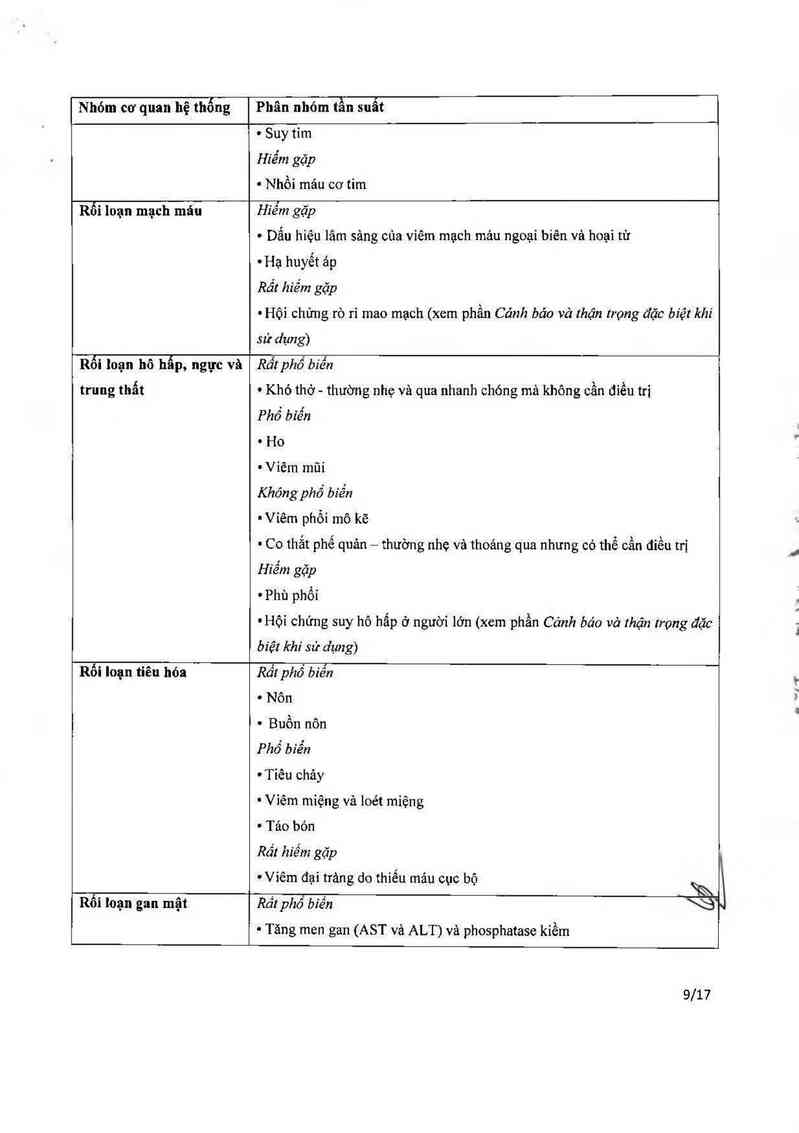
Rối Ioạn tim mạch
Không phố biển
~ Chứng loạn nhịp tim, chủ yếu về bản chất là trên thất
8/17
Nhóm cơ quan hệ thống
Phân nhớm tần suất
' Suy tim
Hiếm gặp
0 Nhôi mảu cơ tim
Rối loạn mạch máu
Hiểm gặp
' Dấu hiệu lâm sảng cùa viêm mạch mảu ngoại biên và hoại tử
— Hạ huyết áp
Rốt hiểm gặp
' Hội chứng rò rỉ mao mạch (xem phằn Cảnh bảo và thận lrọng đặc biệt khi
sử dụng)
Rối loạn hô hấp, ngực và
trung thẫt
Rất phổ biến
' Khó thờ - thường nhẹ và qua nhanh chóng mà không cằn điều trị
Phổ biến
' Ho
' Viẽm mũi
Khóng phổ bíển
~ Viêm phổi mô kẽ
' Co thẳt phế quản — thường nhẹ và thoảng qua nhưng có thể cần điều trị
Hiếm gặp
~Phù phổi
tHội chứng suy hô hấp ở người lởn (xem phần Cảnh báo vả thận trọng đặc
biệt khi sử dụng)
Rối loạn tiêu hỏa
Rất phổ biến
' Nôn
' Buồn nôn
Phổ biển
' Tiêu chảy
' Viêm mỉệng vả loét miệng
. Tảo bón
Rất hiểm gặp
— Viếm đại trảng do thiểu mảu cục bộ
Rối loạn gan mật
%
Rầtphổ biến
~ Tăng men gan (AST vả ALT) vả phosphatase kiếm
9/17
uVi1’
Nhóm cơ quan hệ thống
Phân nhỏm tần suất
Phổ biễn
' Tăng bilirubin
Khôngphổ biển
' Nhiễm độc gan nghiêm trọng, bao gồm suy gan vả tử vong
Hiếm gặp
~ Tăng gamma-glutamyl transferase (GGT)
Rối loạn da và mô dưới
da
Rẫt phổ biến
' Dị ứng nổi mấn trên da thường kèm theo ngứa
~ Rụng tóc
Phổ biến
. Ngứa
. Đổ mồ hôi
Hiểm gặp
' Dị ứng da nghiếm trọng, bao gồm cả tróc vảy và phát ban mụn mủ
' Loét
~ Hình thảnh mụn nước vả lở loét
' Trỏc vây
Rất hiểm
* Hoại từ thượng bi nhiễm độc
' Hội chửng Stevens-Johnson
Rối loạn về cơ xương và Phổ biến
mô liên kết 0 Đau lưng
* Đau cơ
Rối loạn thận vit tiết niệu Rấtphổ biến
' Đái ra mảu
— Protein nỉệu dạng nhẹ
Khỏngphổ biến
' Suy thận (xem phẩn Cảnh báo và thặn trọng đặc biệt khi sử dụng)
0 Hội chứng tản huyết - tăng ưrế máu (xem phần Cảnh báo vả thận trọng
đặc biệt khi sử dụng)
Rối loạn chung và tại chỗ
Rất phố bíền
' Cảo triệu chứng giống củm — cảc triệu chứng phổ biến nhắt là sốt, đau đầu,
10/17
ln:
Nhóm cơ quan hệ thống Phân nhóm tần suất
ớn lạnh, đau cơ, suy nhược vả bỉếng ăn. Ho, viêm mũi, khó chiu, đổ mồ hôi
vả khó ngủ cũng đã được bảo cảo.
' Phù/phù ngoại biên, bao gồm cả phù mặt. Phù nề thường hồi phục sau khi
ngưng điều trị.
Phổ biến
oSốt
. Suy nhược
' Ớn lạnh
Hiếm gặp
~ Phản ứng tại chỗ tiếm - chủ yếu là nhẹ về bản chất
Các biến chứng chẩn Hiểẵ gặp
thương, ngộ độc và do 'Độc tính xạ trị (xem phần T ương tác với các thuốc khác vả các dạng
thủ thuật tương tác khác)
~ Phản ứng da nghiêm trọng xảy ra khí hóa trị được dùng trong hoặc ngay
sau khi xạ trị (radiation recall)
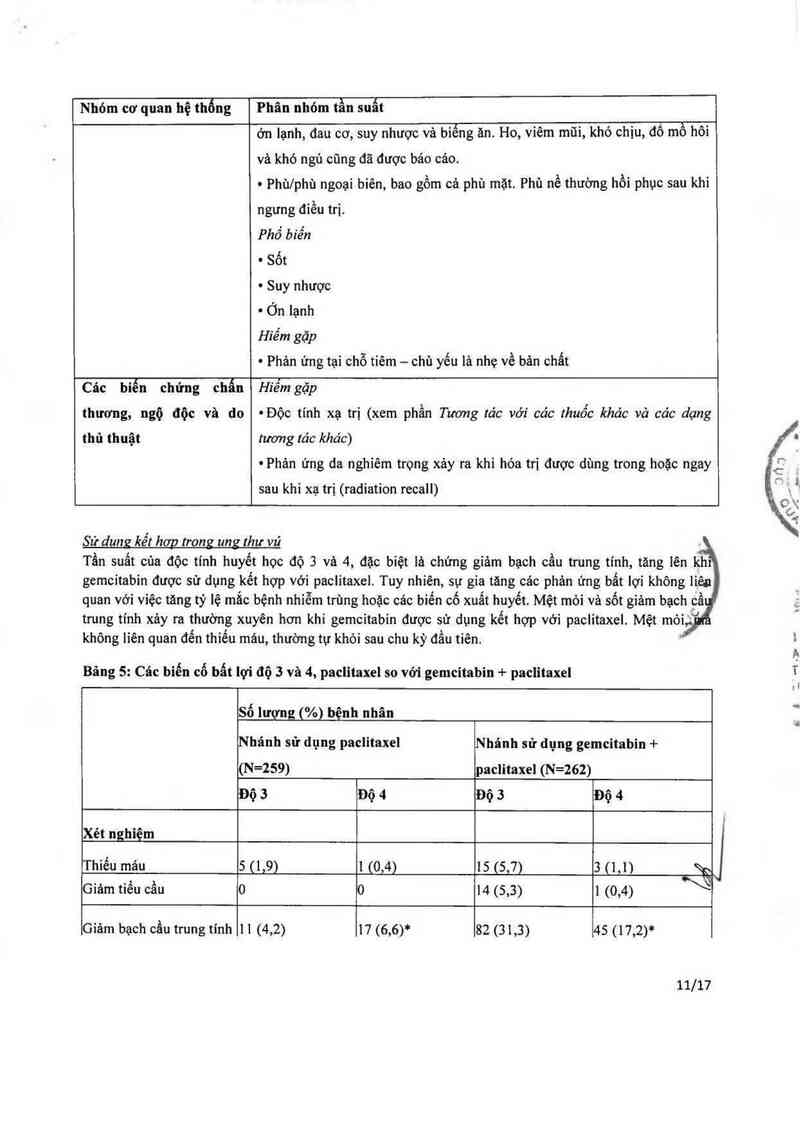
Sử dung kể: hơg trong ung ihư vú
Tần suất của độc tính huyết học đó 3 vả 4, đặc biệt lả chứng giám bạch cầu trung tinh, tăng lên khi
gemcitabin được sử dụng kết hợp với paclitaxel. Tuy nhiên, sự gia tăng cảc phản ứng bất lợi không iiến
quan với việc tảng tỷ lệ mắc bệnh nhiễm trùng hoặc các biến co xuất huyết. Mệt mỏi và sốt giảm bạch cầ
trung tinh xảy ra thường xuyên hơn khi gemcitabin được sử dụng kết hợp với paclitaxel. Mệt mòi,;
không liên quan đến thiếu mảu, thường tự khỏi sau chu kỳ đầu tiến.
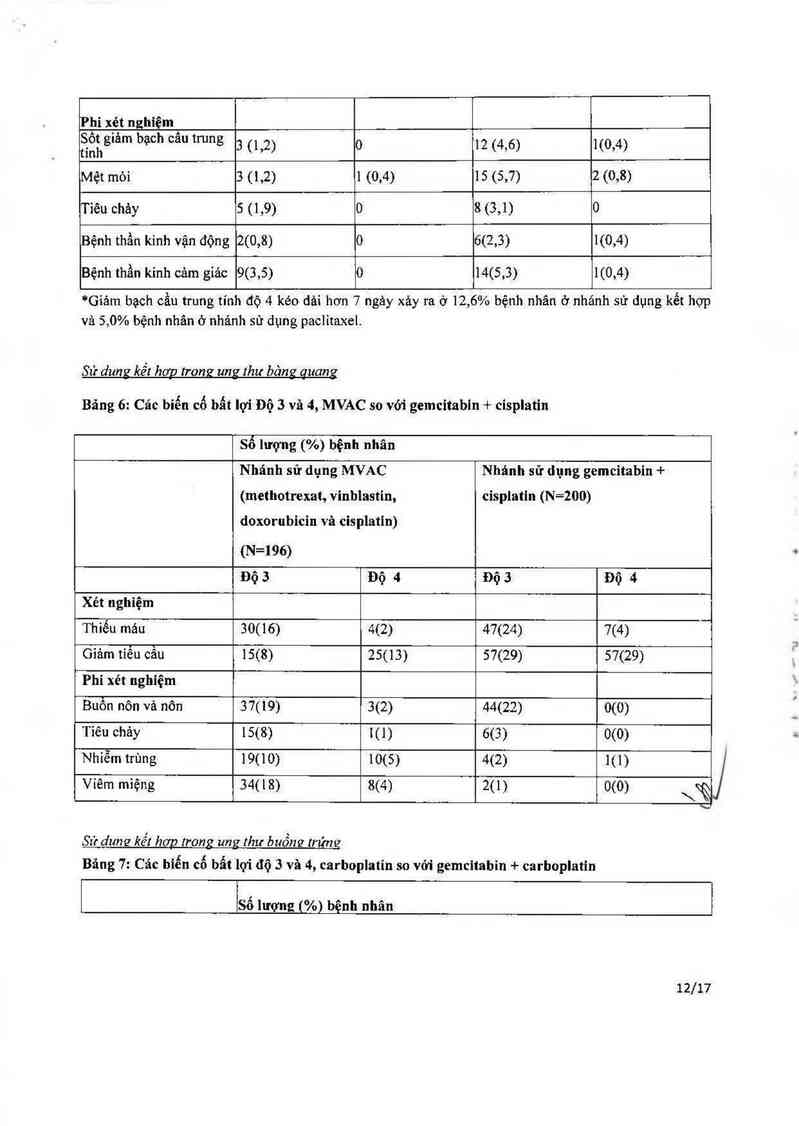
Bâng 5: Các biến cố bất lợi độ 3 vả 4, paclitaxel so với gemcitabin + paclitaxel
Số lượng (%) bệnh nhân
Nhảnh sử dụng paclitaxel Nhánh sử dụng gemcitabin +
(N=259) paclitaxel (N=262)
IĐộ 3 LĐộ 4 Độ 3 Độ 4
Xét nghiệm
Thiếu máu 5 (1,9) 1 (0,4) 15 (5,7) 3 (1,1) ầ
Giảm tiếu cẩu o 0 14 (5,3) 1 (0,4)
Giảm bạch cầu trung tính 11 (4,2) 17 (6,6)* 82 (31,3) 45 (17,2)*
11/17
Phi xỌét nghiệm À
tsỉẵhglám bạch cau trung 3 (1,2) 0 12 (4,6) 1(0,4)
Mệt mòi 3 (1,2) 1 (0,4) 15 (5,7) 2 (0,8)
Tiêu chảy 5 (1,9) 0 8 (3,1) 0
Bệnh thần kinh vận động 2(0,8) 0 6(2,3) 1(0,4)
Bệnh thần kinh cảm giảc 9(3,5) 0 14(5,3) 1(0,4)
*Giảm bạch cầu trung tính độ 4 kéo dải hơn 7 ngảy xảy ra ở 12,6% bệnh nhản ờ nhảnh sử dụng kết hợp
và 5,0% bệnh nhân ở nhảnh sử dụng paclitaxe1.
Sứ dungr kết hop trong ung thư bảng auang
Bãng 6: Các bỉến cố bẩt lợi Độ 5 và 4, MVAC so với gemcitabin + cisplatin
Số lượng (%) bệnh nhãn
Nhánh sử dụng MVAC
(methotrexat, vinblastin,
doxorubicin vả cisplatin)
Nhánh sử đụng gemcitabin +
cisplatin (N=200)
(N=196)
Độ 5 Độ 4 Độ 3 Độ 4
Xét nghiệm
Thiếu máu 30(16) 4(2) 47(24) 7(4)
Giảm tiều cẫu 15(8) 25(13) 57(29) 57(29)
Phi xét nghiệm
Buồn nôn vả nôn 37(19) 3(2) 44(22) 0(0)
Tiêu cháy 15(8) 1(1) 6(3) 0(0)
Nhiễm trùng 19(10) 10(5) 4(2) 1(1)
Viêm miệng 34(18) 8(4) 2(1) 0(0) \
Sử dung kết hơp rrong ung thư buồng trứng
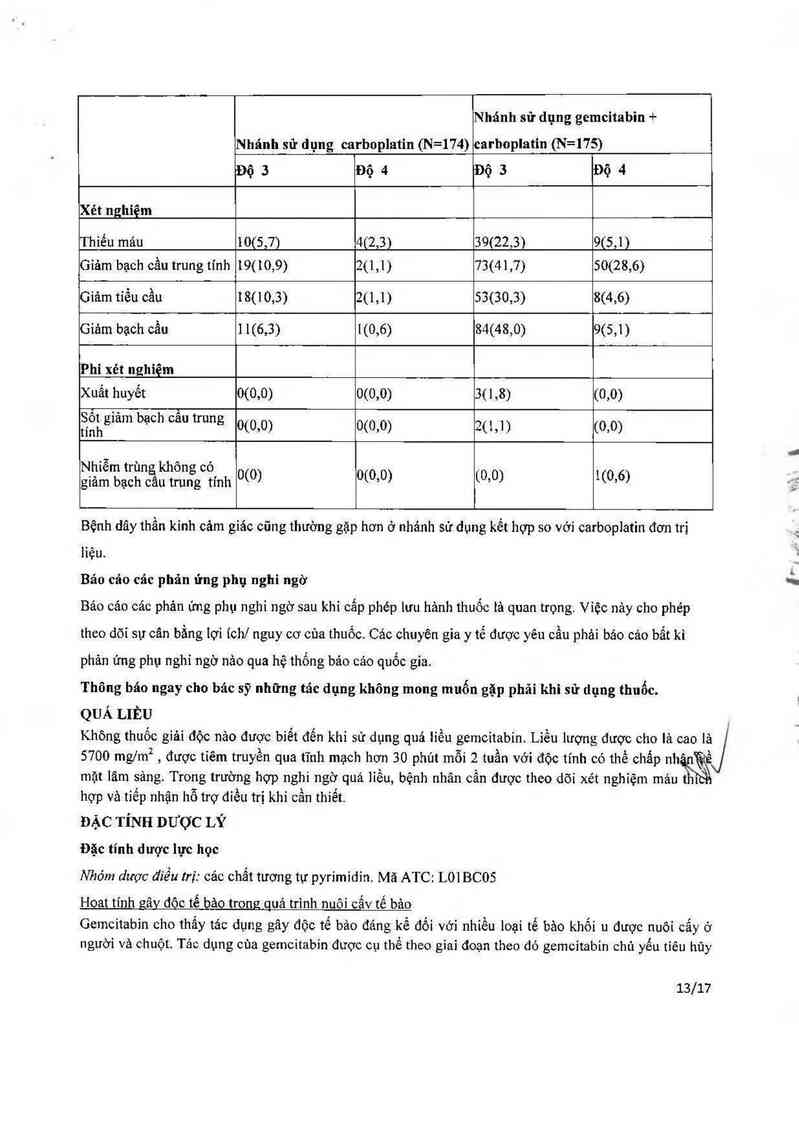
Bảng 7: Các biến cố bẩt lợi độ 3 và 4, carhoplatin so vởi gemcitabin + carboplatin
Số lượng (%) bệnh nhân
12/17
Nhánh sử dụng gemcitabin +
Nhánh sử dụng carboplatin (N=174) carhoplatin (N=175)
Độ 3 Độ 4 Độ 3 Độ 4
Xét nghiệm
Thiếu mảu 10(5,7) 4(2,3) 39(22,31 9(5,1)
Gỉảm bạch cầu trung tinh 19(10,9) 2(1,1) 73(41,7) 50(28,6)
Giảm tỉếu cầu 18(10,3) 2(1,1) 53(30,3) 8(4,6)
Giảm bạch cẩu 11(6,3) 1(0,6) 84(48,0) 9(5,1)
Phi xét nghiệm
Xuất huyết 0(0,0) 0(0,0) 3(1,8) (0,0)
tSíỄhgiảm bạch câu trung 0(0’0) 0(0’0) 20,1) (0’0)
Nhiễm trùng không có
giảm bạch câu trung tính 0(0) 0(0,0) (0’0) 1(0’6)
Bệnh dây thần kinh cảm giảc cũng thường gặp hơn ở nhảnh sử dụng kết hợp so với carboplatin đơn trị
liệu.
Báo cáo các phản ứng phụ nghi ngờ
Báo cảo các phản ứng phụ nghi ngờ sau khi cẳp phép lưu hảnh thuốc 1â quan trọng. Việc nảy cho phép
theo dõi sự cân bằng lợi ich/ nguy cơ của thuốc. Các chuyến gia y tế được yêu cầu phải báo cảo bất kì
phản ứng phụ nghi ngờ nảo qua hệ thống báo cảo quốc gia.
Thông báo ngay cho bảc sỹ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
QUÁ LIÊU
Không thuốc giải độc nảo được biết đến khi sử dụng quá liếu gemcitabin. Liều lượng được cho là cao là
5700 mgim² , được tiêm truyền qua tĩnh mạch hon 30 phút mỗi 2 tuần với độc tính có thế chấp nh `Ệi`
ế
mặt lâm sảng. Trong trường hợp nghi ngờ quá liếu, bệnh nhân cần được theo dõi xét nghỉệm máu t 1Ă\
hợp và tiếp nhận hỗ trợ điếu trị khi cần thíết.
ĐẶC TÍNH DƯỢC LÝ
Đặc tính dược lực học
Nhóm dược điều trị: các chắt tương tư pyrimidin. Mã ATC: L01 BCOS
Hoat tính gây đôc tế bảo trong guả trình nuôi cẳv tế bảo
Gemcitabin cho thấy tác dụng gây độc tế bảo đảng kể đối vởi nhiều loại tế băo khối 11 được nuôi cẩy ở
người và chuột. Tảo dụng cùa gemcitabin được cụ thể theo giai đoạn theo đó gemcitabin chủ yếu tỉêu hủy
13l17
cảc tế bảo đang trải qua tổng hợp ADN (pha S) vả, trong những trường hợp nhắt định, ngăn chặn sự tiến
triến cùa các tế bảo ở đỉếm giao cùa ranh giới pha 6115. Trên in vitro, tác dụng gây độc tế bảo cùa
gemcitabin phụ thuộc vảo cả nồng độ và thời gian.
Hoat tính chộne u bướu trong cảc mộ hinh tiến lâm_@g
Trong cảc dạng khối 11 động vật, hoạt tính chống u bướu của gemcitabin phụ thuộc vảo lịch trình. Khi
gemcitabin được sử dụng hảng ngảy, đã quan sát thẳy tỷ lệ tử vong cao ở cảc loải động vặt, nhưng hoạt
tính chống u bướu tối thỉểu. Tuy nhiên, nếu gemcitabin được sử dụng vâo mỗi ngảy thứ ba hoặc thứ tư, có
thể dùng với liếu không gây chết vởi hoạt tính chống u bướu đảng kế chống lại phố rộng cùa các khối 11 ở
chuột.
Cơ chế tác đunc
Sự chuyến hóa tế bảo và cơ chế tảc dụng: Gemcitabin (dFdC), lả một chất chống chuyền hoá nhóm
pyrimidin. Gemcitabin được chuyển hóa nội bảo bởi men nucleosid kinase thảnh các nucleosid
diphosphat (dFdCDP) vả triphosphat (dFdCTP) có hoạt tính. Tảo dụng gây độc tế bảo cùa gemcitabin là
do ức chế tổng hợp ADN bằng hai cơ chế tác dụng bởi dFdCDP vả dFdCTP. Đầu tiên, dFdCDP ức chế
ribonucleotid reductase, lả men duy nhất xúc tảo phản ứng tạo ra đeoxynucleosid triphosphat (dCTP)
nhằm tổng hợp ADN. Ức chế men nảy bởi dFdCDP sẽ lâm giảm nồng độ deoxynucleosid nói chung, đặc
biệt 1ả nồng độ dCTP. Thứ hai 1ả, dFdCTP cạnh tranh với dCTP để gắn vảo ADN (tự kích hoạt tiếm lực).
Tương tư, một lượng nhỏ gemcitabin cũng có thể gắn vảo ARN. Do đó, giảm nổng đó nội bảo cùa dCTP
khiến cho việc gắn dFdCTP vảo ADN dễ đảng hơn. ADN polymerase epsilon không có khả nảng loại bỏ
gemcitabin vả sừa lại chuỗi ADN đang phảt triển. Sau khi gemcitabin gắn vảo ADN, ] nucleotid nữa gắn
thếm vảo chuỗi ADN đang phát triển. Sau khi gắn thêm nucleotid nảy, sự tổng hợp ADN thưc sự bị ức
chế hoản toản (kết thủc chuỗi ẩn). Sau khi gắn vảo ADN, gemcitabin thúc đẳy quả trinh chết tế bâo theo
chương trinh, được gọi 1ả apoptosis
Đặc tinh được động học
Dược động học của gemcitabin đã được xem xét trên 353 bệnh nhân trong 7 nghiên cứu, gồm 12] nữ và
232 nam tuổi từ 29 đến 79. Trong số cảc bệnh nhân nảy, khoảng 45% bị ung thư phổi không phải tế bảo
nhỏ và 35% bị ung thư tuyến tụy. Các thông số dược động học sau đây đạt được với các liều trong khoảng
từ 500 đến 2592 mg/m², truyền trong 0,4 đến 1,2 giờ.
Nồng độ đinh trong huyết tương (đạt được khoảng 5 phút sau khi truyền xong) lả 3,2 đến 45,5 ụg/ml.
Nồng độ trong huyết tuơng của hợp chất gốc sau một liếu 1000 mg/m²l3O phút lớn hơn 5 ttg/ml trong
khoảng 30 phút sau khi truyền xong, và lớn hơn 0,4 ug/ml trong một gìờ bổ sung.
Phân bộ
Thể tich phân bố của khoang trung ương lả 12,4 ilm² đối với nữ và 17,5 ilm² đối với nam (tỷ lệ khág bi t
giữa người nảy và người khác lả 91,9%). Thế tich phân bố cũa khoang ngoại vi in 47,4 Ilm², thể t
khoang ngoại vi không thay đổi theo giới tính.
Độ gắn kết protein trong huyết tương được coi là không đảng kế.
Thời gian bán thải: Từ 42 đến 94 phút, tùy theo tuối vả giởi tính. Với thời biền dùng thuốc được khuyến
nghị, gemcitabin hầu như được thải trừ hoản toản trong vòng 5 đến 11 giờ kế từ lúc bắt đầu truyền.
Gemcitabin không tich tụ trong cơ thể khi dùng 1 mẩn ] lằn.
14/ 17
Chuvến hg' a
Gemcitabin được chuyến hóa nhanh chóng tại gan, thận, máu và cảc mô khảc bới men cytìdin deaminase.
Chuyến hóa nội bảo của gemcitabin sản sinh ra gemcitabin mono, di, vá triphOSphat (dFdCMP, dFdCDP,
dFdCTP) trong đó dFdCDP vả dFdCTP được xem là có hoạt tính. Không thấy các chất chuyến hóa nội
bảo nảy trong huyết tương hay nước tỉểu. Chất chuyền hóa ban dầu 2'-deoxy-2', 2' difluoroudin (dFdU)
không có hoạt tính và được tìm thấy trong huyết tương và nước tiều.
Thải trừ
Thanh thải toản thân dao động từ 29,2 i/giờ/m² đến 92,2 i/giờxm² tùy thuộc vảo giới tính và tuổi (biến
thiên giữa người—ngườí là 52,2%). Thanh thải đối với nữ là thấp hơn khoảng 25% so với cảc giá trì áp
dụng cho nam giới. Mặc dù nhanh chóng, thanh thải cho cả nam và nữ dường như giảm dần theo tuổi. Đối
với liều gemcitabin khuyến nghị 1000 mg/m2 truyền trong 30 phủt, giá trị độ thanh thải thấp hơn đối với
nữ và nam không bắt buộc cần phải giảm liều gemcitabin.
Bải tiết qua nước tiếu: Ít hơn 10% được bải tiết dưới dạng không đổi.
Độ thanh thải qua thận là 2-7 l/gỉờ/mz.
Trong suốt tuần tỉếp theo sau khi truyền, 92 đến 98% liều gemcitabin dược phục hổi, 99% trong nước
tiểu, chủ yếu dưới dạng dFdU và 1% liều dùng được đảo thải qua phân.
Đông hoc của dFdCTP
dFdCTP có thể tìm thấy trong cảc bạch cằu đơn nhân ở mảu ngoại biên và các thông tin sau đây dề cập
đến những tế bâo nảy. Nồng độ nội bảo tăng tỉ lệ thuận với liều gemcitabin ss-aso mg/m²iso phủt, liều
gemcitabin nảy tạo ra nổng dộ ổn dinh lả 0,4-5 ụg/ml. Khi nồng độ cùa gemcitabin trong huyết tương cao
hơn 5 ụglml thì nồng độ dFdCTP không tăng nữa, diều nây cho bíết sự tạo thảnh dFdCTP đã bão hòa
trong tế bảo.
Thời gian bản thải cùa sự thải trừ cuối cùng: o,1-12 giờ.
Đông hoc của ngU
Nồng độ đỉnh trong huyết tương (đạt được 3-15 phút sau khi kết thủc 30 phút truyền với liều 1000
mglm²)z 28-52 ụg/ml. Nồng độ đảy khi dùng 1 tuần ] lần: 0,07-1,12 ụg/ml, không có sự tích tụ thuốc rõ
rệt. Đường cong nồng độ huyết tương 3 pha theo thời gian, hay thời gian bán thải trung bình của pha cuối:
65 giờ (khoảng 33 đến 84 giờ).
Tỷ lệ dFdU được hình thảnh từ hợp chất ban dẩu: 91%-98%.
Thể tích phân bố trung bình của khoang trung ương: 18 iJm² (khoảng i i đến 22 I/m²).
Thể tích phân bố è… đinh trung bình (Vss): 150 iJm² (khoảng 96 đến 228 iJm²).
Phân bố tại mô: rất nhiều.
Độ thanh thải biểu kiến trung bình: 2,5 l/giờ/mz (khoảng 1 đến 4 I/giờ/mz).
Thảí trừ qua dường tiếu: Toản bộ.
Liên nháp kết hơn zemcitabin vả Daciitaxel
Liệu pháp kết hợp không lảm thay đối đặc tính dược động học của cả gemcitabin hoặc pa '
Liêu pháp kết hgg gemcitabin vả carboplatin
Dược động học của gemcitabin không thay đổi khi được sử dụng cùng với carboplatin.
15]17
'no
Suv thân
Người suy thận mức độ nhẹ đến trung bình (GFR từ 30 mllphút đến 80 ml/phút) không có ảnh hưởng
đảng kề, nhắt đinh đổi với dược động học cùa gemcitabin.
Dữ liệu an toi… tiền lâm sâng
Trong các nghiên cứu dùng liều lặp lại với thời gian lên tởi 6 tháng ở chuột vả chó, phát hiện chính là ức
chế có hồi phục sự tạo mảu phụ thuộc lich trình và liều lượng.
Gemcitabin gây đột bỉến trong thử nghiệm đột biến in vitro và thử nghiệm vi nhãn tùy xương in vỉvo. Các
nghiên cứu dải hạn trên động vật đảnh giá tiềm năng gây ung thư chưa được tiến hânh.
Trong các nghỉên cứu sinh sản, gemcitabin gây suy giảm quá trình sản sinh ra tính trùng có thể hồi phục ở
chuột đực. Không thấy ảnh hưởng đến khả nâng sinh sản cùa chuột cải.
Đảnh giả về nghỉên cứu động vật thực nghỉệm đã cho thấy độc tính sinh sản, ví dụ như, di tặt bẩm sinh và
các ảnh hưởng khảo đến sự phảt triển cùa phôi thai hoặc thai nhi, quá trình thai nghén hoặc phảt triến chu
sỉnh và sau khi sinh.
TƯỜNG KỊ
Không được trộn thuốc nảy vởi cảc thuốc khảo, ngoại trừ những thuốc được đề cập trong phần T hận trọng
đặc biệt pha.
HẠN DÙNG
Lọ chưa mở: 24 tháng kế từ ngảy sản xuất.
Dung dịch đã hoản nguyên:
Độ ổn định vật lý và hóa học trong khi sử đụng đã được chứng minh trong 24 giờ ở 300C. Theo quan
diếm vi sinh, thuốc nên đuợc sử dụng ngay. Nếu không dùng ngay, thời gian bảo quản sau pha và điều
kỉện trước khi dùng lá trách nhiệm cùa người sử dụng và thường không lâu hơn 24 giờ ở nhiệt độ phòng,
trừ khi việc hoản nguyên (và pha loãng thêm, nếu có) diễn ra trong đỉều kiện vô trùng có kíểm soát và đã
được thấm định.
Dung dịch gemcitabin đả hoả…n nguyên không nên để trong tủ lạnh vì có thể xảy ra kết tinh.
THẶN TRỌNG ĐẶC BIỆT KHI BẢO QUẢN
Lọ chưa mở: Bảo quản ở nhỉệt độ không quá 30°C.
Điều kiện bảo quản cùa thuốc đã hoản nguyên, xem phần Hạn dùng.
BẢN CHẤT VÀ DUNG LƯỢNG BAO BÍ ĐÓNG GÓI `
Lọ thùy tinh cứng ]oại [, với nút cao su và nắp nhôm kểt họp vởi nút đậy polypropylcổi
Hộp chửa 1 lọ.
THẶN TRỌNG ĐẶC BIỆT KHI PHA
Xử lý
16/17
_
\n
Các biện pháp phòng ngừa an toản thông thường đối với cảc thuốc gây độc tế bảo phải được chấp hảnh
khi pha chế và loại bỏ dung dich truyền. Xử lý dung dịch truyền phải được tiến hânh trong một buồng an
toản và phải sử dụng áo khoác vả gảng tay bảo vệ. Nếu không có sẵn buồng an toân, cần phải bổ sung
trang thiết bị như mặt nạ và kính bảo vệ.
Nếu chế phẩm tiếp xúc với mắt, có thể gây kích ứng nghiêm trợng. Cần rừa sạch mắt ngay lập tức và rửa
kĩ bằng nước sạch. Nếu kích ứng kéo dải, cần tham vấn ý kiến bác sĩ. Nếu dung dich dổ trân trên da, rửa
sạch kĩ bằng nước.
Hướng dẫn hoản nguỵên (vả pha loãne thêm. nếu đươc thưc hiên)
Dung môi pha Ioãng duy nhất được phê duyệt để hoản nguyên bột vô trùng gemcitabin iâ dung dich natri
clorid pha tiêm 9mgml (0,9%) (không chứa chất bảo quản). Do khả năng hòa tan của gemcitabin, nồng
độ tối đa gemcitabin sau khi hoãn nguyên là 40 mg/ml. Cần trảnh pha thuốc ở nồng độ lớn hơn 40 mng
vì có thể thuốc không được hòa tan hoản toản.
!. Sử dụng kỹ thuật vô trùng trong quá trinh hoản nguyên và pha loãng thêm gemcitabin đề truyền tĩnh
mạch.
2. Đề hoản nguyên, thêm Sml dung dịch pha tiêm vô trùng natri clorid 9 mglml (0,9%) không chứa chất
bảo quân vảo lọ 200mg hoặc 25ml dung dich pha tiêm vô trùng natri ciorid 9 mglml (0,9%) không chứa
chất bảo quản vâo lọ lOOOmg. Tổng thể tích sau hoân nguyên tương ứng là 5,26m1 (iọ 200mg) hay 26,3m1
(lọ lOOOmg), tạo ra nồng độ gemcitabin là 38 111ng mà bao gồm thể tích thay thế cùa bột đông khô. Lắc
để hòa tan. Có thể thực hiện pha loãng thêm với dung dich pha tỉêm natri clorid vô trùng 9 mg/ml (0,9%)
không có chất bảo quản. Dung dịch đã hoân nguyên là dung dich trong, không mảu đến vảng nhạt.
3. Thuốc tiêm truyền phái được kiềm tra bằng mắt về vấn để tiền phân vả biến mảu tmớc khi tiêm truyền.
Nếu quan sát thấy tiểu phân, không được sử dụng.
Bất kỳ sản phẩm chưa sử dụng hoặc nguyên liệu phế thải phải được xử lý phù hợp với yê
phương.
Để xa tầm tay trẻ em
Đọc kỹ hưởng đẫm sử dụng trước khi dùng
Nếu cẩn thêm thông tin xin hỏi ý kiến bảc sĩ
SẢN XUẤT BÓ'l
GLENMARK GENERICS S.A.,
Calle 9 lng. Meyer Oks N°593, Parque Industrial Pilar,
Provincia dc Buenos Aires, Ac-hen—ti-na.
Dựa trên ccos Oi TUQ— CỤC TRUỜNG
P.TRUỞNG PHÒNG
Jifạuỵễn e7Ổ(ả( Jfểìnỵ
17/17
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng