












` ’ ZM/gẵ JSz
Artwork of seconda ;
' BỘ Y TẾ
cục QUẢN LÝ DƯỢC
XXXX-XX-XX Í
““““ Lân đâuzẢẫJ...ẤL/ẤỦÁ
XXXXX
\\\\\\\\\\Ắ —1
i1Mìl 011 I 11… M] xsm rl'w wa] xsms
\!
“'DACII-ìEN'“ '“DAũIầEN” "DACII-ìEN’" "DACIIỀEN'“
doeltablne 50 mg decitabin 60 mg deeitabine 50 mg deoỉtabin 50 mg
I
Bột ph: dịch 00111 056 dẻ Manufactured byISản xuâi bởi. PMQr for conamme for solution sm … z~c Iu re
' ~ Rommtiưled ioluhon Unlas used vain
Phì dung Ủễ°h WVỒH ỈÚ mạch P“'Mhmm B.v., swenmeg 5 ' 2031 for Infusion 15 minutes otmmnátmon, me 61… MW r
………… ……………… c
. . … feleas y 1 irm…llumummmuTC-qu p 6“
Sau 'f'“ WF nguyên. ’ '" dung dia Va qug xưởng bởi Jgnmnm g Atter moomtmtton. 1 ml ot mlution for tn mmnum … m… …11 u…mắ
Phi U… dua 5 N deulabm. Pharmaceutiu NV. Tumhot meweg gq_ inịection contain 5 mg decitabine. mmm, aummmm, omunndiulmt
B-2340 Beene. BelgiumlBt mu mm: mtơmumư mụ to en… …
muộc BẤN meo … qu1 Xứ² Bf mzscmmou om.v Bâo quln a z-c … m
ĐỂ XATẦII TAY TRẺ EM ch, J nm. m. TM L KEEP out OF REACH OF cmu›aeu 0… am … nuuy0n Trứ … ú dvm —
Đọc xỷ 11176116 DẢN sữ DỤNG 'tnm_ " ' ' " READ THE LEAFLET cmeruuv ỄẵẾ ỂỀỀỀỀỀ'ỄỂỀỀẾ ắ"…ẵ ắffl
TRƯỞC KHI DUNG ẸằNễ.fẩgtsdmũx Bmh Dươl'lũ. BEFORE USING lenũtmyòn để W (TC - fCi Vì bỗ° quin
m ớz'c—o'cnaugnooenkmnommuen
\ SĐK'VN-uxxx—xx \ CMđnhdơtdủng.ohờìodúdỵnhvơcf
thóngtin ko mumtmngtòhưbnud n
JỒI'ÌSSGIÌ ’ Hử… jỒI'ÌSSGI'I ’ ……an
DACII-ìEN" ~ềề
decitabine 50 mo
0 Janssm—Cilag 2015
SP_Dacogen_v1
h'Ẩ :. u'l I, /
S_toteÌềffleeojỗand B°C.
fcrẽomentrate for solution for intusion
Bảo quản ở 2°C dén 8°C.
Bộtpha dịchđậmđặcđếphadtmdịchtmyèntĩnhmạủ
Manufactured bylSản xuất 0011
lan,,en7- Phamoheme av. The NetheriandslHâ Lan
L
docitabỉne 50mg
NSX Mụ. dablleD m:
Padted and re1eased by/Đóng oói va xuất xưởng bỏi: ă
1 Janssen Phamaoeutica NV. Beig'um/Bỉ ẵ
0me mm 9 8 5 8 3 Ô
Ĩ
ài
PP_Dacogen_vl
ZM/ 52
theo đơn của bảc sỹ.
ử odụng trưởc khi dùng._l
DACOGEN Qdecitabin) dạng tiêm lả bột đông khô vô khuấn có mã… trắng đến trắng hơi ngả.
Mỗi lọ đơn lỉẽu 20mL chứa 50mg decitabin.
Sau khi hoân nguyên với IOmL nước tinh khiết pha tỉêm trong diều kiện vô khuẩn, mỗi mL dung
dịch đậm đặc để tiếm truyền chứa 5mg dccitabin.
Tá dược: Kali dihydrogen phosphat, natri hydroxid.
CHỈ ĐỊNH
DACOGEN được chỉ định trong:
0 Điều trị bệnh nhân bị hội chứng loạn sản tủy (myelod stic syndromes -MDS) bao gồm
MDS đã được điều trị và chưa được điều trị trước đây, MDS nguyên phát và thứ phát ở tắt
cả cảc phân nhóm theo hệ thống phân loại cùa Pháp-Mỹ-Anh (thiếu máu dai dắng tiến
triển, thiểu máu dai dẳng tiến triến với hiện diện cùa nguyên hồng cầu có nhân bất
thường không điền hình với cảc hạt sắt dạng vòng trong ty thế (refractory anemia with
rỉnged sideroblasts), thiếu máu dai dẳng tiến triển với nguyên bảo tăng quá mức, thiếu
máu dai dắng tiến tiền với tăng quá mức nguyên bảo đang biến đổi và bệnh bạch cẩu dòng
tùy mạn tính) và cảc nhóm nguy cơ Trung binh — 1, Trung binh — 2 và nhóm Nguy cơ cao
theo hệ thống thang đỉếm đảnh giá tiên lượng quốc tế.
. Điều trị bệnh nhân người iớn từ 65 tuổi trở lên mới được chẩn đoản bệnh bạch cầu dòng
tủy cấp tính (acute myeloid ieukemia- AML) nguyên phát hoặc thứ phát, theo phân Ioại
cùa _Tổ chức Y tế Thế giới , không au điếu kiện cho liệu pháp hóa trị dẫn nhập tiêu
chuân.
LIẺU DÙNG VÀ CÁCH DÙNG
DACOGEN phải được sử dụng dưới sự giám sảt cùa các bác sĩ có kinh nghíệm sử dụng các tác
nhân hóa trị liệu.
Liều dùng
Có 2 phác đồ được khuyến cảo cho việc sử dụng DACOGEN. Phác đồ dùng thuốc 5 ngảy trong
điều trị AML, vả phác đồ 3 ngây hoặc 5 ngảy trong điếu trị MDS. Với mỗi phảc đồ, bệnh nhân
được khuyến cảo điều trị tối thiểu là 4 chu kỳ; tuy nhiên, đáp ứng có thể đạt được sau hơn 4 chu
kỳ. Trong nghiên cứu pha 3 về AML, trung vị thời gian đến khi đáp ứng (đảp ứng hoản toản [CR]
hoặc đảp ứng hoân toản với sự phục hồi tiếu cầu không đầy đủ [CRpD lả 4,3 tháng. Trong nghiên
cửu vế MDS, trung vị thời gian đến khi đáp ứng (CR + PR) trong các nghiên cứu pha 2 về MDS
với phác đồ dùng thuốc S ngảy là 3, 5 chu kỳ. Trong nghiên cứu pha 3 vê MDS với phác đồ dùng
thuốc 3 ngảy, trung vị thời gian đến khi đáp ứng là 3 chu kỳ. Có thể tiếp tục điều trị mỉễn là bệnh
nhân cho thấy có đáp ứng, tiếp tục có lợi ích hoặc biều hiện bệnh on định, nghĩa lả, không có dấu
hiệu bệnh tiến triến.
Nếu sau 4 chu kỳ, các trị số huyết học của bệnh nhân (như số lượng tiếu cầu hoặc bạch cầu trung
tính tuyệt đối) vẫn chưa trở về giá trị trước khi điều trị hoặc bệnh tỉến triển (tăng dần số lượng
nguyên bảo ngoại bỉến hoặc số lượng nguyên bảo tủy lxương xấu đi), thì bệnh nhân có thể được
xem là không đảp ứng với điếu trị vả nên cân nhắc đến biện pháp điều trị khác thay thế
DACOGEN.
Không khuyến cáo dùng thuốc chống buồn nôn và chống nôn thường quy trước khi truyền
DACOGEN, nhưng có thể dùng nếu cẩn.
Pl _Dacogen CCDS 255ep.2ffl4_v1 1/16
VI
Phác đồ điều trị bệnh bạch cẩu dèng tủy cấp tính (AML)
Trong 1 chu kỳ điểu trị, sử dụng DACOGEN với liếư 20mgím2 diện tích bề mặt cơ thể bằng cảch
truyền tĩnh mạch hơn 1 giờ mỗi ngảy trong 5 ngảy iiên tỉếp (nghĩa là tống cộng 5 iiếu cho mỗi chu
kỳ điều trị). Tổng lìếu thuốc mỗi ngây không được vượt quá 20mg/m2 vả tống lỉều cho mỗi chu
kỳ điều trị không được vượt quá lOOmg/m². Chu kỳ nến được lặp lại mỗi 4 tuần tùy theo đáp ửng
lâm sảng cùa bệnh nhân vả. độc tính của thuốc được ghi nhận. Nếu bỏ lỡ 1 líều thuốc, phải tiểp tục
điều trị lại cảng sớm cảng tốt. Có thế sử dụng phảc đồ nảy cho bệnh nhân đỉều trị ngoại trú.
Phác đồ điều trị hội chứng Ioạn sản tủy
Phảc đồ 3 ngảy điều trị hội chứng loạn sản tủy
Trong 1 chu kỳ điều trị, sử dụng DACOGEN 3 ngảy liên tục với liếư cố định lả iSmg/m2 diện tích
bề mặt cơ thế, mỗi lần truyền tĩnh mạch trong 3 gỉờ và mỗi 8 giờ dùng thuốc một tần (nghĩa là
tống cộng 9 liếư cho mỗi chu kỳ điều trị). Chu kỳ nảy sẽ được lặp lại khoáng mỗi 6 tuần tùy theo
đáp ứng lâm sảng của bệnh nhân vả độc tinh cùa thuốc được ghi nhận. Tổng liếư thuốc mỗi ngảy
không được vuợt quá 4Smg/m2 và tổng lỉều cho mỗi chu kỳ điếu trị không được vượt quá
l35mg/mz. Nếu bỏ lỡ ] liều thuốc, phải tiếp tục đíều trị lại cảng sớm cảng tốt.
/
Phác đồ 5 ngảy điệu trị hội chứng Ioạn sản tủy QẢW/ ` `
Trong 1 chu kỳ điêu trị, sử dụng DACOGEN với liếư 20mg ỉện tích bê mặt cơ thế, mỗi lân
truyền tĩnh mạch hơn 1 giờ và lặp lại liều mỗi ngảy trong 5 ngảy lỉến tiếp (nghĩa là tổng cộng 5
liếư cho mỗi chu kỳ điều trị). Tổng líếu thuốc mỗi ngảy không được vượt quá 20mg/m2 vả tổng
liều cho mỗi chu kỳ điều trị không dược vượt quá lOOmg/mz. Chu kỳ nảy sẽ được lặp lại khoảng
mỗi 4 tuần tùy theo dáp ứng lâm sảng cùa bệnh nhân và độc tính của thuốc được ghi nhận. Nếu bỏ
lỡ 1 liều thuốc, phải tiễp tục điểu trị lại cảng sớm câng tốt Có thể sử dụng phảc đồ nảy cho bệnh
nhân điếu trị ngoại trú.
Xử trí tình trạng ức chế tủy và các biến chứng Iiên quan
Úc chế tủy vả cảc biến có bẩt iợi có liên quan đến ức chế tủy (giảm tiểu cầu, thiếu máu, giảm
bạch cầu trung tính, và giảm bạch cằu trung tính có sốt) iả phổ biến ở cả bệnh nhân AML vả MDS
được điếu trị và khộng dược điếu trị Các biển chứng của ức chế tủy bao gồm nhỉễm trùng và
chảy máu. Có thể điều chỉnh việc điều trị ở những bệnh nhân bị ức chế tủy và các bíến chửng liên
quan như mô tả dưới đây:
Trọng bệnh bach cầu dòng tủy cấp tính:
Điều trị có thể bị trì hoãn theo quyết định cùa bác sĩ điếu trị, nếu bệnh nhân có các bỉến chứng
liên quan đến' ưc chế tủy, chắng hạn như được mô tả dưới 0đây
Í Giảm bạch cầu trung tính có sốt (nhiệt độ >38, 50 C và số lượng bạch cầu trung tinh tuyệt
đối <1.000 /uL)
f Nhiễm vi rủt, vi trùng hoặc nấm thể hoạt động (nghĩa là cần dùng cảc thuốc chống
nhiễm trùng đường tĩnh mạch hoặc chăm sóc hỗ trợ tích cực)
Í Xuất huyết (tiêu hóa, sinh dục-tiểt niệu, phồi vởi tiểu câu QS. 000/11L hoặc bất kỳ xuất
huyết hệ thống thần kinh trung ương nảo)
Điều trị với DACOGEN có thế được bắt đầu lại khi những tinh trạng trên đã cải thiện hoặc đã Ổn
định với điều trị đầy đủ (liệu phảp chống nhiễm trùng, truyền máu, hoặc cảc yếu tố tăng truớng).
Không nên giảm liếư dùng
Trong hội chứng !oạn sản tãy
Phác đồ 5 ngảỵ
Không khuyến cảo giảm iiều dùng trongphác dỗ [âm sảng nảy để tối ưu hóa lợi ích cho bệnh
nhân, liếư lượng nên được trì hoãn như sauz`
J Phác đỏ chỉnh liêu trong 3 chu kỳ đâu tiên
Pl_Dacugen CCDS 25 SepZ.ẽj 14…01. 2116
Trong suốt những chu kỳ điếu trị đầu tiên, giảm tế bảo máu độ 3 và 4 là phố biển và có thế
không đại diện cho sự tiến triến cùa MDS. Tình trạng giảm tế bảo mảu trước khi điểu trị có
thế không cái thiện cho đến sau chu kỳ 3.
Đối với 3 chu kỳ đầu tiên, để tối ưu hóa iợi ích cho bệnh nhân trong tình trạng có giảm bạch
cầu trung tính mức độ trung binh (số lượng bạch cầu trung tính tuyệt đối 1.000/11L và
số lượng tiều cầu> 50.000/11L), bệnh nhân nên ngừng thuốc điều trị và được đánh giá về tiến
triến bệnh (xảo định bằng cảch chọc hủt tùy xương) trong vòng 7 ngảy sau khi kết thủc 8
tuần. Đối với bệnh nhân đã được điều trị ít nhất 6 chu kỳ, và những người tiếp tục được
hưởng lợi từ điếu trị, có thế cho phép kéo dâỉ trì hoãn quả 8 tuần, trong trường hợp không có
tiến triến, theo quyết định cùa bác sĩ điếu trị.
Phác đồ 3 ngảỵ
Í Phác đồ chính Iiềư trong 3 chu kỳ đầu tiên
Trong suốt những chu kỳ điều trị đầu tiên, giảm tế bâo máu độ 3 và 4 là phổ biến và có thế
không đại diện cho sự tiến triến của MDS. Tình trạng giảm tế bảo máu trước khi điều trị có
thế không cải thiện cho đến sau chu kỳ 3.
Đối với 3 chu kỳ đẩu tiên, để tối ưu hóa lợi ích cho bệnh nhân trong tình trạng có giảm bạch
cầu trung tính mức độ trung bình (số lượng bạch cầu trung tinh tuyệt đối 1.000/ị1L và số
lượng tiếu cầu › 50.000/ụL) từ một chu kỳ điều trị DACOGEN trước đó, với tinh trạng giảm
tế bảo máu dai dẳng mã được xem có liên quan đến việc dùng thuốc kéo dải hơn 6 tuần, nên
hoãn chu kỳ điều trị kế tiếp của DACOGEN vả iièu thuốc được giảm theo thuật toán sau.
Tất cả việc giảm liều xảy ra cần duy tri tác dụng trong thời gian của hóa trị, không nến tăng
iiếu bậc thang lại.
P! Dacogen _CCDS ZSSep.ÉOM_ vi 3116
<\U\
0 Nếu thời gian phục hồi vượt quá 6 tuần, nhưng dưới 8 tuần — nên trì hoãn sử dụng
DACOGEN đển 2 tuần và tải điều trị với liều được giảm còn iimglm² mỗi 8 giờ
(n hĩa in 33 mglm²lngảy, 99 ngm²/chu kỳ).
0 N u thời gian phục hồi vượt quá 8 tuần, nhưng duới 10 tuẫn — nên trì hoãn sử dụng
DACOGEN đên 2 tuần và tái điều trị với liều được giảm còn 11 ngm² mỗi 8 giờ
(nghĩa là 33 mglm²/ngảy, 99 mg/mzlchu kỳ), sau đó duy trì ở cảc chu kỳ tiếp theo như
chỉ định lâm sảng.
0 Nếu thời gian phục hổi vượt quá 10 tuần, bệnh nhân nên được ngừng điếu trị thuốc và
được đánh giá tiển triến bệnh (bằng cách chọc hút tủy xương) trong vòng 7 ngảy sau
khi kết thúc 10 tuần. Tuy nhiên, đối với các bệnh nhân đã được điều trị ít nhất 6 chu
kỳ, và những người tiếp tục được hưởng lợi từ điều trị, có thế được phép trì hoãn kéo
dải quai 10 tuần theo quyết định cùa bác sĩ điểu trị, trong trường hợp không có bệnh
tiên triên.
Các nhỏm dân số đặc biệt:
Bếnh nhân nhi: Chưa xác lập tính an toản và hiệu quả của thuố ^nh nhi.
Suv gan: Chưa thực hiện các nghiên cứu ớbệnh nhân suy gan. Sự cần thiểt phải điếu chỉnh Iiếu ở
bệnh nhân suy gan chưa được đánh giá. Nêu chức năng gạn xấu đi, bệnh nhân phải được theo dõi
cân thận. (xem Cảnh báo và thận trọng và Đặc tính dược động học).
Suv thân: Chưa thực hiện cảc nghiên cửu ở bệnh nhân suy thận, tuy nhiên, dữ liệu từ cảc thử
nghiệm lâm sảng bao gổm những bệnh nhân bị suy thận nhẹ — trung binh cho thấy không cần thiết
phải điếu chinh iiếu. Bệnh nhân suy thận nặng đã bị ioại khói những thử nghiệm nảy (xem Đặc
tính dược động học).
Cách dùng
DACOGEN được dùng bằng cách truyền tĩnh mạch. Không cần đặt ống thông tĩnh mạch trung
tâm. Đế được hướng dẫn ve cảch hoảnnguyên và pha loãng thuốc trước khi dùng, xem mục
Hướng dẫn sử dụng và Xử lý vả Hủy thuôc.
CHỐNG CHỈ ĐỊNH , '
- Các trường hợp được biêt mẫn cảm với decỉtabin hoặc bât kỳ tả dược nảo (xem Tá dược)
- Phụ nữ cho con bú (xem Phụ nữ có thai, cho con bú và khả năng sinh sản)
CẢNH BÁO VÀ THẬN TRỌNG
Ửc chế tủy
Tình trạng ửc chế tùy và các bỉến chứng của ức chế tùy, bao gổm nhiễm trùng và chảy máu xảy ra
ở bệnh nhân bị MDS hoặc AML có thế bị trầm trọng hơn khi dùng DACOGEN. Tinh trạng ức chế
tửy do DACOGEN có thể phục hổi. Nên xét nghiệm thường xuyến công thức máu toản phần và
số lượng tiểu cầu khi có chỉ định lâm sảng và trước mỗi chu kỳ điều trị. Nếu bệnh nhân có tình
trạng ức chế tủy hoặc có các biến chứng của ức chế tủy, việc điếu trị với DACOGEN có thế bị
gián đoạn, liếư sẽ được giảm hoặc thực hiện các biện pháp điếu trị hỗ trợ như khuyến cáo trong
mục Liều dùng vả Cách dùng và Tác dụng không mong muốn.
Su an
Sử dụng DACOGEN ở bệnh nhân suy gan chưa được xảo iập. Cần thận trọng trong việc dùng
DACOGEN cho bệnh nhân suy gan vả bệnh nhân nên được theo dõi chặt chẽ (xem phần Liều
dùng vả Cách dùng và Đặc tính dược động học).
Suv thân
Pi Oacogen_CCDS 25Se02014_w ụ16
..-. «* 1
'v. -
Sử dụng DACOGEN ở những bệnh nhân suy thận nặng chưa được nghiên cứu. Cần thận trọng khi
sử dụng DACOGEN cho bệnh nhân suy thận nặng (độ thanh` thải creatinin [CiCl] < 30 mL/phủt)
và những bệnh nhân nảy nên được theo dõi chặt chẽ (xem phân Liều dùng vả Cách dùng).
Bênh tim
Bệnh nhân có tiền sử suy tim xung huyết nặng hoặc bệnh tim không ốn định trên lâm sảng đã
được loại trừ khói các nghiên cứu lâm sảng vả do đó tính an toản và hiệu quả cùa DACOGEN ở
những bệnh nhân nảy chưa được xảo lập.
Tả _d_ươc
Mỗi lọ thuốc chứa 0, 5 mmol kali. Sau khi hoản nguyên và pha loãng dung dịch để truyền tĩnh
mạch, thuốc có chứa 1- 10 mmol kali/liếu phụ thuộc vảo dịch truyền để pha loãng. Cần cân nhắc ở
bệnh nhân suy giảm chức năng thận hoặc bệnh nhân có chế độ ăn kiềm soát kali
Mỗi lọ thuốc chứa 0,29 mmol natri. Sau khi hoản nguyên và pha Ioãng dung dịch để truyền tĩnh
mạch, thuốc có chứa 0, 6— 6 mmol natri/liếu phụ thuộc vảo dịch truyền để pha loãng. Cẩn cân nhắc
ở bệnh nhân có chế độ ăn kiếm soát natri. mA/
TƯO'NG TÁC VỚI CÁC THUỐC KHÁC VÀ CÁC DANGỞ G TÁC KHẢC
Chưa tiến hảnh các nghiên cứu lâm sảng chính thức về tương tảc thuốc với decitabin.
Thuốc nảy có khả năng tương tác với các thuốc khác, vôn cũng được hoạt hỏa bới chuỗi phản ứng
phosphoryl hóa (qua hoạt động cùa phosphokinase nội bảo) vảlhoặc được chuyến hỏa bời các
enzym tham gia vảo quả trinh bất hoạt decitabin (như cytidin deaminase). Vì vậy, cần thận trọng
nêu kểt hợp nhũng thuốc nảy với DACOGEN.
Tác động của cảc thuốc đùng đồng thời đối vởỉ decitabin
Không dự đoán được cảc tương tác thuốc chuyến hóa qua trung gian CYP4SO bởi vì chuyền hóa
decitabin không qua trung gian cùa hệ thống nảy mà bằng cảch khử amin oxy hóa. Có thế không
xảy ra việc cảc thuốc dùng đồng thời cạnh tranh đẩy decitabin ra khỏi vị trí gắn kết với protein
huyết tương vì decitabin gắn kết không đáng kể vâo protein huyết tương in vitro (< 1%). Dữ liệu
in vitro cho thấy dccitabin iâ một chất nến P-glycoprotein (P-gp) có hoạt tính kém, vả do đó
không dễ tương tác với các chất ức chế P-glycoprotein.
Tác động của decitabin đối với các thuốc dùng đồng thời
Vi ít gắn kết với protein huyết tương in vitro (< 1%), decitabin có thế không đẫy các thuốc dùng
đồng thời ra khói vị trí gắn kết với cảc protein huyết tương của chủng.
Nghiên cứu in vitro cho thấy decitabin không ức chế cũng như không kích hoạt các enzym CYP
450 lên đến hơn 20 Iần nồng độ điếu trị tối đa trong huyết tương quan sát được (C,…) Như vậy,
không dự đoản được các tương tác thuốc chuyến hóa qua trung gian CYP và có thể không tương
tác với cảc thuốc chuyến hóa thông qua cảc con đường nảy. Decitabin đã được chứng minh là một
chất ửc chế yếu sự vận chuyến qua trung gian P-gp in vitro và do đó cũng không ảnh hưởng đến
sự vận chuyến qua trung gian P- -gp cùa những thuốc điều trị đồng thời (xem Đặc tính dược động
học).
pnụ NỮ có THAI, CHO CON BÚ VÀ KHẢ NĂNG SINH SẢN
Phụ nữ có thai
Nên khuyên phụ nữ có khả năng sinh con sử dụng cảc biện phảp trảnh thai và tránh có thai trong
lủc điều trị với DACOGEN. Chưa rõ khoảng thời gian an toản đế có thai sau khi sử dụng
DACOGEN. Không có dữ Iiệu đầy đủ về việc sử dụng DACOGEN ở phụ nữ mang thai. Các
nghiên cứu đã chỉ ra rằng decitabin gậy quái thai ở chuột và chuột nhắt (xem Thông tin tiến lâm
sâng). Chưa biết được nguy cơ tiềm ân vởi con người. Dựa trên kết quả từ cảc nghiên cứu trên
động vật và cơ chế hoạt động của thuốc, không nên sử dụng DACOGEN trong thời kỳ mang thai,
trừ khi thật sự cần thiết. Nếu thuốc nảy được sử dụng trong thời kỳ mang thai, hoặc nếu một bệnh
nhân mang thai trong khi dùng DACOGEN, bệnh nhân nên được thông bảo về những mối nguy
hiềm tiềm tâng đối với thai nhi.
Pi Oacogen_CCDS ZSSepZOM_M 5116
Dùng thuốc ở bệnh nhân nam: Nên khuyên bệnh nhân nam không nên có con trong lúc đùng
DACOGEN vả 3 thảng sau khi kết thúc điếu trị (xem Thông tin tỉền lâm sảng).
Khả năng sinh sản
Nên khuyến bệnh nhân nữ có khả năng mang thai tham khảo tư vấn về bảo quản lạnh tế bảo trứng
trước khi bắt đầu điều trị với DACOGEN. Nên khuyến bệnh nhân nam xin tư vắn về việc lưu trữ
tỉnh trùng trước khi đỉều trị vì trị liệu vởi DACOGEN có thể gây hậu quá vô sinh.
Cho con bú
Chưa rõ decitabin hoặc cảc chất chuyến hóa của decitabin có được bải tiết qua sữa mẹ hay không.
Chống chỉ định dùng DACOGEN trong iúc cho con bú; do đó nếu cẩn điều trị với DACOGEN,
phải ngừng cho con bú sữa mẹ (xem Chống chỉ định).
ẨNH HƯỞNG TRÊN KHẢ NĂNG LẢI XE vÀ VẶN HÀNH MÁY MÓC
Chưa có nghiên cứu về ảnh hướng của DACOGEN iên khả năng lảỉ xe hoặc vận hânh máy móc.
Nên lưu ý cho bệnh nhân bỉết có thể gặp các tác dụng không mong muốn trong quá trình điểu trị
như thiếu máu. Do đó, khuyến cảo bệnh nhân nên thận trọng khi lái xe hoặc vận hảnh mảy móc.
TÁC DỤNG KHÓNG MONG MUÔN
Dữ líệu nghiên cứu lâm sâng /
Các phản ứng bất lợi được báo Cảo trong phần nảy. C 11 ứng bẩt lợi là cảc biển cố bất lợi
được xem là có liên quan với việc sử dụng DACOGEN dựa trên đảnh giá toản cliện các thông tin
có sẳn về cảc biến có bất lợi Mối quan hệ nhân quả với DACOGEN không thể được thiết lập một
cách chắc chắn trên các trường hợp riêng iẻ Hơn nữa, bời vì các thử nghiệm lâm sảng được tiến
hảnh dưới các điếu kỉện rất khác nhau, tỷ lệ cảc phản ứng bất lợi quan sát được trong cảc thử
nghiệm iâm sảng của một lơại thuốc không thế so sánh trực tiếp với tỷ iệ trong cảc thử nghiệm
lâm sảng của thuốc khảo và có thế không phản ảnh tỷ lệ quan sát được trong thực hảnh lâm sảng.
Các phản ứng bất lợi thường gặp vả quan trỌng nhất ở cả hai phác đồ 3 ngảy và S ngảy lả sự ức
chế túy và các hậu quả cùa tinh trạng ức chế tùy.
Phản ửng bất lợi
Tính an toân cùa DACOGEN được đánh gỉả trong các nghiên cứu iâm sảng ở 682 bệnh nhân
AML vả MDS (D- 0007, DACO- 016, DACO- 017, DACO-O20, EORTC- 06.011 và IDO3- 0180)
Trong cảc nghiến cứu lâm sảng nảy, DACOGEN được dùng với phác đồ 5 ngảy hoặc 3 ngảy.
Phản' ưng bất lợi được báo cáo trOng các nghiên cứu iâm sảng nảy được tóm tắt trong Bảng 1 dưới
đây Các phản ứng bất lợi được liệt kê theo tần suất. Tần suất được quy định như sau: Rất phổ
biến (_>_ 1/10), Phổ biến (_ 11100 đến <1110) và Không phổ biến (> l/l, 000 đến <11100).
Trong mỗi nhóm tẩn suất, các phản ứng bất lợi được trình bảy theo thứ tự mức độ nghiêm trọng
giảm dân.
Pi i’Jaưigen CCDS Zõổepềì'ĩi—i 01 6116
~J I\D
“a- API
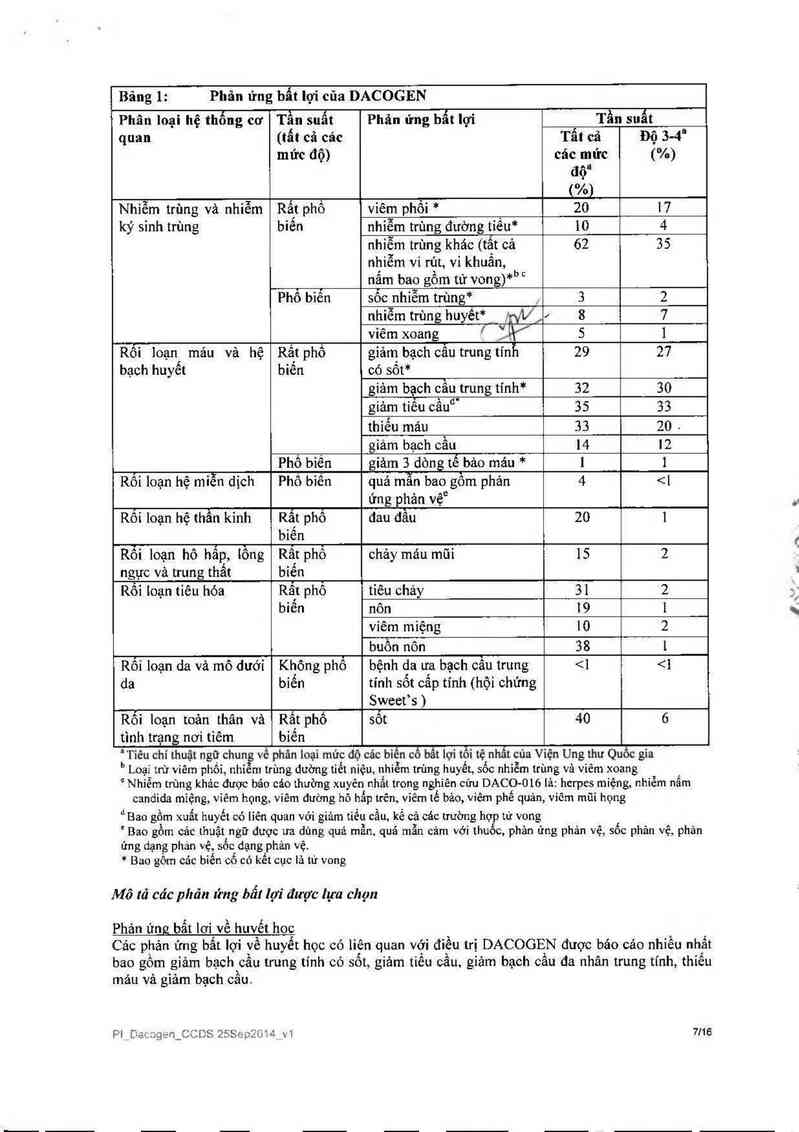
Bảng 1: Phân ứng bẩt lợi của DACOGEN
Phân loại hệ thống cơ Tần suất Phân ứng bẫt lợi Tần suất
quan (tẩt cả các Tẩt cả Độ 3-4“
mức độ) các mức (%)
độ"
("/9)
Nhiễm trùng và nhiễm Rất phổ vỉêm phối * 20 17
ký sinh trùng bỉến nhỉễm trùng đường tiều* 10 4
nhiễm trùng khác (tắt cả 62 35
nhiễm vi rút, vi khuẩn,
nắm bao gổm tứ vong)*bc
Phổ biển sốc nhiễm trùng* , 3 2
nhiễm trùng huyết* _ 1nV/ 8 7
viêm xoang ’ Ế 5 l
Rỗi loạn mảu và hệ Rất phổ giảm bạch câu trung tính 29 27
bạch huyết biến có sốt*
giảm bạch cẩu trung tính* 32 30
giảm tiễu cẩudi 35 33
thiếu máu 33 20 .
giảm bạch cẩu 14 12
Phố bìến giảm 3 dòng tế bảo máu * l 1
Rối loạn hệ mỉễn dịch Phổ biến quá mẫĨi bao gổm phản 4 2Ủ 4 xi
I`\l
Phản ửng bật lợi iiên quan đến nhiễm trùng nghỉêm trọng như sốc nhiễm trùng, nhìễm trùng huyết
và viêm phôi dã được bảo cáo ở những bệnh nhân đíêu trị với DACOGEN.
Phản ứng bất iợi có liên quan đến chảy mảu nghiêm trọng như ›iuẳt huyết hệ thẩn kinh trung ương
(1%) và xuấthuyêt tiêu hóa (2%), trong bệnh cảnh giảm tìêu cân nặng, đã được bảo cáo ở những
bệnh nhân đỉêu trị với DACOGEN.
Các phản ứng bất lợi về huyết học nên được kiểm soát bằng cảch theo dõi thường quy công thức
mảu toản phần và cảc đìếu trị hỗ trợ khi cần. Các phương phảp điếu trị hỗ trợ bao gổm, sử dụng
khảng sinh dự phòng vả/hoặc hỗ trợ yếu tố tãng trưởng (ví dụ như G-CSF) cho giảm bạch câu
trung tính vả truyền máu trong trường hợp thiếu mảu hoặc giảm tiếu cầu theo hướng dẫn. Đối vởi
cảc tình huống phải trì hoãn dùng decitabin, xem phần Liều dùng và cách dùng.
Dữliệu hậu mãi
Không có thêm phản ứng bất lợi nảo được xác định trong các phân tích về dữ iiệu an toản hậu
mãi. |
Thông báo cho bác sĩ những tác dụng không mong muốn gặp % đùng thuốc.
QUÁ LIÊU
Không có kinh nghiệm trực tỉếp về quá liều ở người vả không có thuốc giải độc đặc hiệu. Tuy
nhiên, dữ liệu nghiên cứu lâm sảng ban dầu trong cảc y vãn đã được xuất bản vởi lỉểu lớn hơn 20
lần so với tiều điếu trị hiện hảnh đã bảo cáo tình trạng ức chế tủy gia tăng bao gồm giảm bạch cầu
trung tính và giảm tiếu cầu kéo dải. Độc tính cùa thuốc có thề biều hiện qua sự tảng trầm trọng
cảc phân ứng bất lợi, chủ yểu lả ức chế tủy (xem Tác dụng không mong muốn). Trong trường hợp
quá liếư, nến xử lý bằng chăm sóc hỗ trợ.
ĐẶC TÍNH DƯỢC LỰC HỌC
Nhóm dược trị !ỉệu: thuốc điếu trị ung thư và điểu hòa mìễn dịch, tương tự pyrimidin
Mã ATC: LOlBCO8
Cơ chế tác dụng
Decitabin (S-aza-2'-deoxycytidin) là chất có cẳu trủc tương tự cytosin nucleosid, có tảc dụng ức
chế chọn lọc cảc men DNA methyltransferase khi dùng liếư thấp, dẫn đến giảm phản ứng methyl
hóa cúa gien khởi điểm mả phản ửng nảy có thề lảm kích hoạt lại cảc gien ức chế khối 0, tạo ra sự
biệt hóa tế bảo hoặc sự giả yểu đi của tế bảo và dẫn đến chết tế bảo theo chương trình.
Nghiên cứu lâm sâng
Nghiên cứu lâm sảng Irên MDS
Nghiên cứu nha 2 (DACO-OZO]: Phảc đồ 5 ngây , _
Một nghiên cứu đa trung tâm, đơn nhánh, nhãn mờ (DACO-ZO) đã được tiên hảnh đê đánh giá
hỉệu quả cùa DACOGEN ở những bệnh nhân MDS với bất kỳ phân nhóm FAB nảo. Trong nghiên
cứu nảy, 99 bệnh nhãn với phân loại tiên iượng IPSS Trung bình- 21 ,Trung bình -2, hoặc nguy co
cam được điếu trị bằng DACOGEN với phác đồ 5 ngảy 20 mg1m²truyền tĩnh mạch chặm hon 1
giờ hảng ngảy, vảo các ngảy l đểu 5 mỗi 4 tuần (1 chu kỳ). Cảo kết quả phù hợp với kết quả cùa
nghiên cửu pha 3 và được tóm tắt trong Bảng 2.
Pl_Dacogen_CCDS 25S6p21114_11 8116
Bảng 2: Hiệu quả cũa DACOGEN trong nghiên cửu pha 2 DACO-020
Thông sô DACOGEN (N=99)
Tỉ lệ đảp ứng toản bộ (CR+mCR+PR) 33 (33%)
Đáp ứng hoản toản (CR) 17 (17%)
Đáp ứng tùy xương hoản toản (mCR) 16 (16%)
Tỉ lệ cải thiện toản bộ (CR+mCR+PR+HD 51 (52%)
CR=complete remỉssỉon (Đảp ứng hoản toản); mCR=marrow complete remission (Đảp ứng tủy
xương hoản toản); PR=partial remission (Đáp ứng một phần); HI= hematological improvement
(Cải thỉện huyết học);
Nguồn: Báo cáo nghiên cứu lâm sảng (CSR) DACO-020
Nizhiên cứu nha 3 iD-OOO7): Phác đổ 3-nRảV
Một nghiên cứu có đối chứng, nhãn mờ đa trung tâm, ngẫu nhiên (D-0007) đánh giả sử dụng
DACOGEN ở 170 bệnh nhân MDS theo các tỉêu chỉ phân loại FAB và theo phân loại tiến lượng
IPSS nhóm có nguy cơ cao, nguy cơ trung bình -2, và nguy cơ trung binh-l. DACOGEN được
dùng với phảc đồ 3 ngảy 15 mg/mz, truyền tĩnh mạch liên tục hơn 3 giờ, lặp lại mỗi 8 gíờ trong 3
ngảy Iiên tiếp cùa mỗi chu kỳ 6 tuần. KV
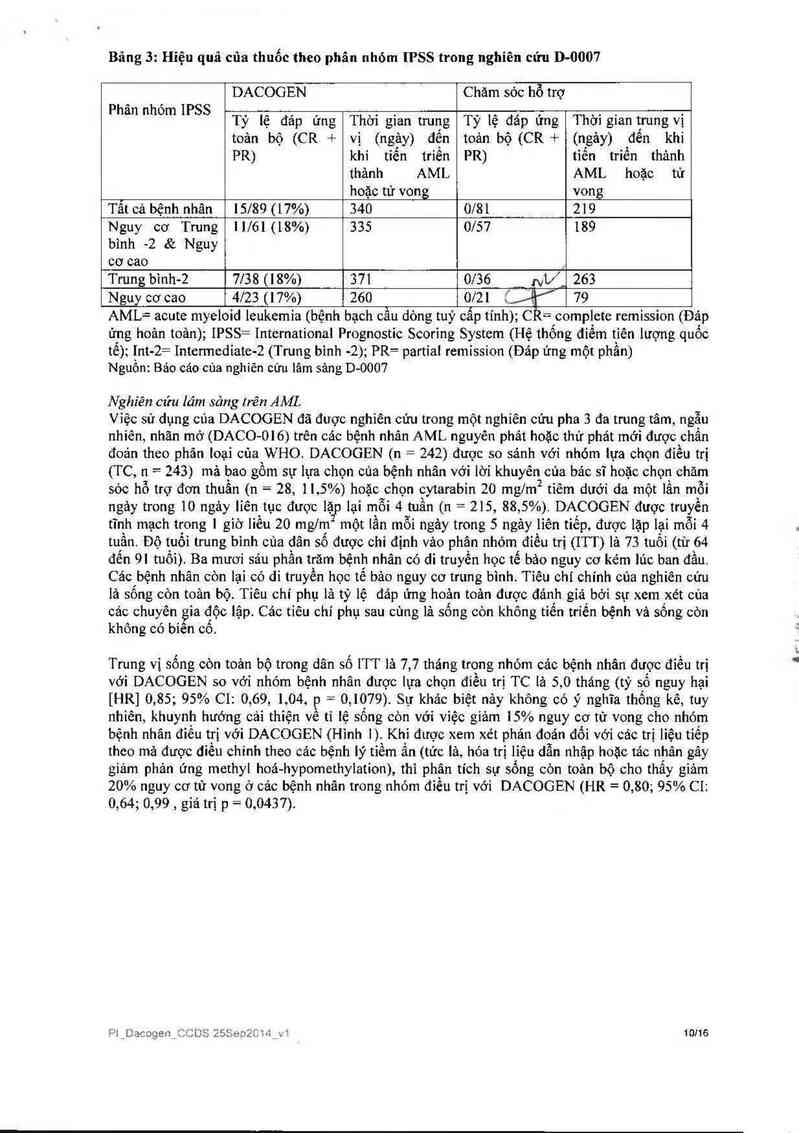
Trong một nghiên cứu lâm sảng pha 3, tất cả cảc phẫn hóm IPSS đến đạt được CR vả PR. Tuy
nhiến, thấy rõ râng hiệu quả lợi ích lớn hơn trong cảc phân nhóm bệnh nhân nguy cơ trung bình -
2 và nguy cơ cao, xem Bảng 3.
Pi Dacogon CCDS 2589p2014_01 9116
Bảng 3: Hiệu quả của thuốc theo phân nhỏ… IPSS trong nghiên cửu D-0007
DACOGEN Chăm sỏc hỗ trợ
Phan nhom IPSS Tỷ lệ đáp ứng Thời gian trung Tỷ lệ đáp ứng Thời gỉan trung vị
toản bộ (CR + vị (ngảy) đến toản bộ (CR + (ngảy) đển khi
PR) khi tiến triển PR) tiến trỉến thảnh
thảnh AML AML hoặc từ
hoặc tử vong vong
Tất cả bệnh nhân 15189 (17%) 340 0/81 219
Nguy cơ Trung 11161(18%) 335 0157 189
bình -2 & Nguy
cơ cao _
Trung binh—2 7138 (18%) 371 0136 NƯ_ 263
Nguy cơ cao 4123 (17%) 260 0121 Í 79
AML= acute myeloid leukemia (bệnh bạch cẫu dòng tuý cẩp tính); C] = complete remission (Đáp
ứng hoản toản); IPSS= International Prognostic Scorỉng System (Hệ thống điếm tiên lượng quỏc
tế); Int-2= Intermediate-2 (Trung binh -2); PR= partiai remission (Đảp ưng một phần)
Nguồn Bảo cáo cùa nghiên cứu lâm sảng D- 0007
Nghiên cửu Iám sòng lrẻn AML
Việc sử dụng của DACOGEN đã được nghỉên cứu trong một nghiên cứu pha 3 đa trung tâm, ngẫu
nhiên, nhãn mờ (DACO-Olớ) trên các bệnh nhân AML nguyên phát hoặc thứ phát mới được chẳn
đoán theo phân ioại cùa WHO. DACOGEN (n— - 242) được so sảnh với nhóm lựa chọn điếu trị
(TC, n = 243) mà bao gồm sự lựa chọn của bệnh nhân với lời khuyên2 cùa bảo sĩ hoặc chọn chăm
sóc hỗ trợ đơn thưẳn (n = 28, 11,5%) hoặc chọn cytarabin 20 mg1m2 tiêm dưới da một lần mỗi
ngảy trong 10 ngảy lỉên tục đượcă 1ă²p lại mỗi 4 tuần (11 = 215, 88,5%) DACOGEN được truyền
tĩnh mạch trong 1 giờ liếư 20 mglm một lần mỗi ngảy trong 5 ngảy lỉên tiếp, được lặp lại mỗi 4
tuần. Độ tuổi trung binh cùa dân sô được chỉ định vảo phận nhóm điếu trị (ITT) là 73 tuối (tư 64
đến 91 tuổi). Ba mươi sáu phần trăm bệnh nhân có di truyên học tế bâo nguy cơ kém lúc bạn đầu
Các bệnh nhân còn lại có di truyền học tế bảo nguy cơ trung bình. Tiêu chí chính của nghiên cửu
lả sống còn toản bộ. Tiếu chỉ phụ lả tỷ lệ đáp ứng hoản toản được đảnh giá bởi sự xem xét của
các chuyên gia độc lập. Các tiếu chỉ phụ sau cùng là sống còn không tiển triến bệnh vả sống còn
không có biến cô.
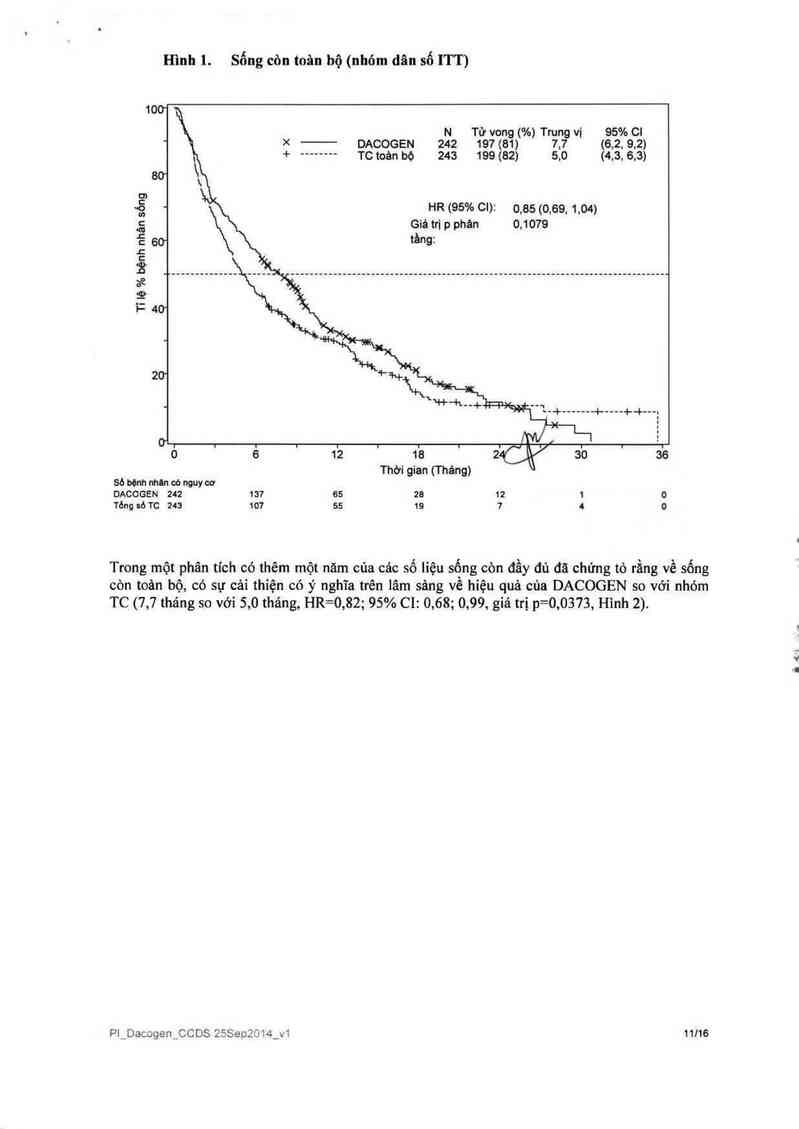
Trung vị sống còn toản bộ trong dân số ITl“ lả 7,7 tháng trong nhóm cảc bệnh nhân được điều trị
với DACOGEN so với nhóm bệnh nhân dược lựa chọn điều trị TC là 5, 0 tháng (tỷ số nguy hại
[HR] 0, 85, 95% C1:0,69, 1,04,p=0,1079).8ự khác biệt nảy không có ý nghĩa thống kê, tuy
nhiến, khuynh hướng cải thiện vê ti 1ệ sông còn với việc giảm 15% nguy cơ tử vong cho nhóm
bệnh nhân điếu trị với DACOGEN (Hình 1). Khi được xem xét phản đoán đổi vởi các trị liệu tiếp
theo mã được điều chinh theo các bệnh lý tiếm ẩn (tức lả, hóa trị lỉệu dẫn nhập hoặc tảo nhân gây
giảm phản ứng methyl hoá- hypomethylation), thì phân tích sự sống còn toản bộ cho thấy gỉảm
20% nguy cơ tử vong ở các bệnh nhân trong nhóm điếu trị vởi DACOGEN (HR= 0,80; 95% CI:
0, 64, 0,99, giá trị p= 0,0437).
®! _Dacogen_CCDS 255ẽDZO'M_-JỂ 10116
Hình 1. Sống còn toân bộ (nhỏ… dân số ITT)
100
N Tử vong (%) Trung vi 95% 01
~ x DACOGEN 242 197 (81) 7.7 (6.2, 9.2)
+ -------- TC toản bộ 243 199 (82) 5,0 (4.3, 6.3)
60
8’
Ý, - HR (95% Cl): 0.85(0.69.1.04)
g Giá tri p phân 0,1079
Ễ 60
.C
:
'3 _ ________________________________________________________________________________
3²
1)
" 40
20
' "`—-+ —————— +----+-+--,
ơ . . . . . , . , . . . . ’.
o 6 12 18 2CY 30 36
Thời gian (Tháng)
50 bộnh nhan eó nguy cơ
DACOGEN 242 137 55 28 12 1 0
Tỏng sỏ rc 243 107 55 16 7 4 0
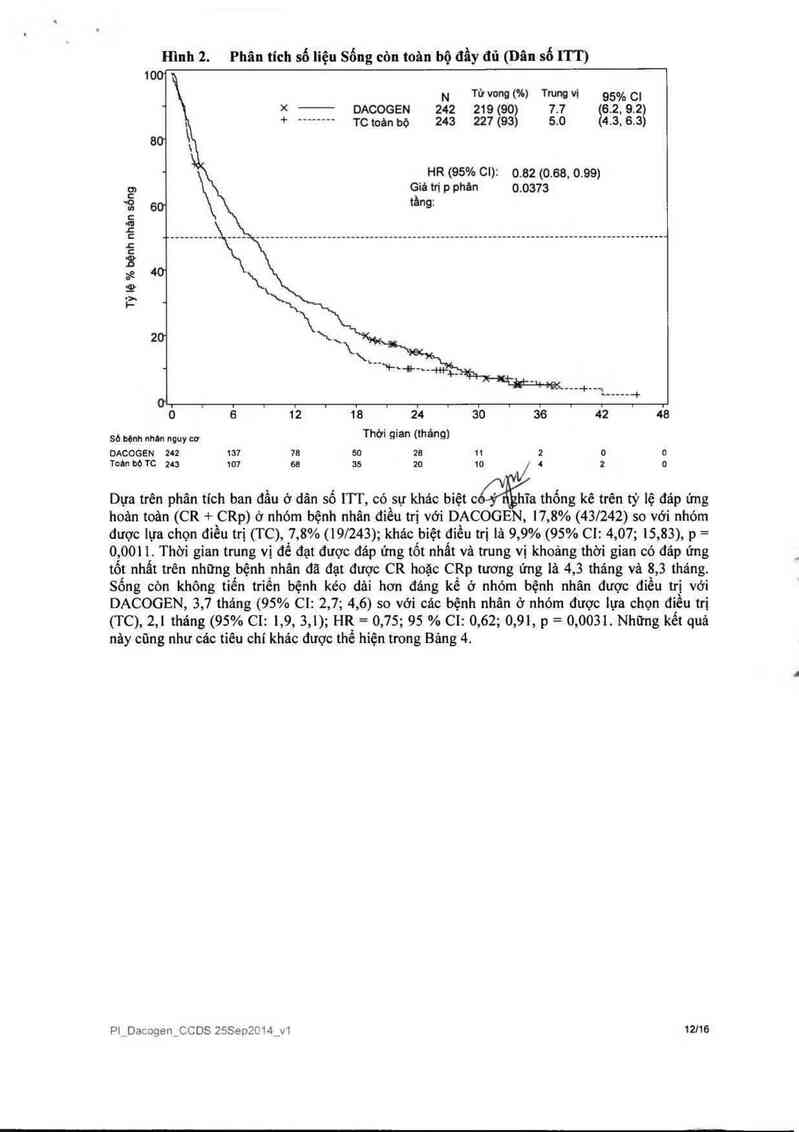
Trong một phân tich có thêm một năm của các số Iiệu số`ng còn đầy dù đã chứng tỏ rằng về sống
còn toản bộ, có sự cải thiện có ý nghĩa trên lâm sảng về hiệu quả của DACOGEN so với nhóm
TC (7,7 tháng so với 5,0 thảng, HR=O,82; 95% CI: 0,68; 0,99, giá trị p=0,0373, Hình 2).
Pi Dacsgen_CCDS 2586132Ủ14__v1
11116
Hình 2. Phân tích số liệu Sống còn toân bộ đầy đủ (Dân số ITT)
100
N Từvong(%) TrungVi 95%01
* >< DACOGEN 242 219190) 77 6.2. 9.2)
+ -------- TCtoần bộ 243 227 (93) 5.0 4.3.63)
60
HR (95% 01): 0.82 (0.68. 0.99)
Giá tn“ p phản 0.0373
60 tầng:
Tỷ lệ % bệnh nhán sóng
… \
20“
L"`F*+-~--iii—+__
---+--— ...... +
0” . . . i . . . . . . .
0 6 12 18 24 30 36 42 48
Số bệnh 11th nguy cơ Thời gian (tháng)
DACOGEN 242 137 78 50 28 11 2 0 0
T0ấfl bộ TC 243 107 68 35 20 10 / l 2 0
Dựa trên phân tích ban đẩu ở dân số 1TT, có sự khảo biệt c '
hĩa thống kê trên tỷ lệ đảp ứng
hoản toản (CR + CRp) ở nhóm bệnh nhân điều trị với DACOGEN, 17,8% (431242) so với nhóm
được lựa chọn điếu trị (TC), 7,8% (191243); khác biệt điều trị là 9,9% (95% C1: 4,07; 15,83), p =
0,0011. Thời gian trung vị để đạt được đáp ứng tốt nhất vả trung vị khoảng thời gian có đáp ứng
tốt nhất trên những bệnh nhân đã đạt được CR hoặc CRp tương ứng 111 4,3 tháng vả 8,3 tháng.
Sống còn không tiểu triến bệnh kéo dái hơn đáng kế 6 nhóm bệnh nhân được điều 111 với
DACOGEN, 3,7 tháng (95% C1: 2,7; 4,6) so với các bệnh nhân ở nhóm được 1ựa chọn điều trị
(TC), 2,1 tháng (95% C1: 1,9, 3,1); HR = 0,75; 95 % C1: 0,62; 0,91, p = 0,0031. Những kết quả
nây cũng như các tiêu chí khảc được thể hiện trong Bảng 4.
Pi Dacogen _CCDS 2E›SepầOM_v1
12116
Bảng 4: Các tiêu chí về hiệu quả khác của nghiên cứu DACO-
016 (dân số ITT)
DACOGEN TC (nhóm kểt Giá trị p
Kết quá 11 = 242 hợp)
11 = 243
CR + CRp 43 (17,8%) 19 (7,8%) 0,001]
OR=2,S
(1,40; 4,78)b
CR 38 (15,7%) 18 (7,4%) -
EFSa 3.5 2.,1 0,0025
(2.3; 4.1)b (1,9; 2,8) “’
HR=O,75
(0,62; 0,90)b
PFSa 3,7 2,1 0,0031
(2,714.6)b <1,913,1›b
HR=O,75
(0,62; 0,91) “*
CR= complete remission (đáp ứng hoản toản); CRp=complete remission
with incomplete platelct recovery (đáp ứng hoản toản với phục hồi tiếu
cầu không hoản toân), EFS= event free survival (sống còn không biến
cố), PFS= progression free survival (sống còn không tiến triến bệnh),
OR= odds ratio (ti sô chênh), HR= hazard ratio (tỉ sô nguy hại)
- = iGiông đánh giá
² Được bảo cảo như là trung vị tháng .7
" Khoảng tin cậy 95% _' xW)
Sống còn toản bộ và cảc tỷ lệ đảp ứng hoản toản trong cảc phân óm có Iiên quan với bệnh được
xác định trước (ví dụ, có nguy cơ di truyền tế bảo, có điếm ECOG [Eastern Cooperative
Oncoiogy Group], tuổi tác, loại AML, vả sô iượng nguyên bảo tùy xương ban đẫu) là nhất quán
với các kết quả của dân sô nghiên cứu toản bộ.
Việc sử dụng DACOGEN như là liệu phảp điếu trị ban đầu cũng được đảnh giả trong một nghiến
cứu pha 2 nhãn mờ, đơn nhảnh (DACO-Ol7) trên 55 các bệnh nhân AML > 60 tuổi theo phân loại
của WHO Tiêu chí chính là tỷ lệ CR được đánh giá bởi sự xem xét của cảc chuyên gia độc lập.
Tiêu chỉ phụ cùa nghiên cứu 1â sống còn toân bộ. DACOGEN được truyền tĩnh mạch trong 1 giờ
với 1iếu 20 mg/m2 một lần mỗi ngảy trong 5 ngảy liên tục được lặp lại mỗi 4 tuần Trong phận
tich ở nhóm 1TT, tỷ lệ CR lả 23, 6% (95% C1: 13,2% đến 37%) trên 13155 bệnh nhân được điếu
trị với DACOGEN. Trung vị thời gian để đạt CR là 4,1 tháng, và trung vị khoảng thời gian có CR
là 18,2 thảng. Trung vị thời gian sống còn toản bộ trong dân số 11*r lả 7,6 tháng (95% c1: 5,7,
11,5).
ĐẶC TÍNH DƯỢC ĐỘNG HỌC
Các thông số dược động học (PK) quần thể cùa decitabin được gộp từ 3 nghiến cứu lâm sảng
[DACO- 017 (11 = 11), DACO- 020 (11 = 11) và DACO— 016 (n— = 23)] sử dụng phảc đồ 5 ngảy (20
mg/m2 x 1 giờ x 5 ngảy mỗi 4 tuần) và một nghiên cứu DACO- 018 (11 = 12), sử dụng phác đồ 3
ngây (15 mg/m2 x 3 giờ mỗi 8 giờ x 3 ngảy mỗi 6 tuần) ở những bệnh nhân MDS hay AML. Ở
phác đồ 5 ngảy, các thông số dược động học cùa decitabỉn được đánh giá vâo ngảy thứ năm của
chu kỳ điếu trị đầu tiên. Tống liếư mỗi chu kỳ là 100 mg] m². Ở phác đồ 3 ngảy, các thông số
dược động học của decitabin được đánh giả sau Iiều2 đầu tiên cùa mỗi ngảy dùng thuốc của chu kỳ
điếu trị đầu tiên. Tống liều mỗi chu kỳ là 135 mg/mz.
Pi Dacunen_CCDS 2588p2014 ,V1 13116
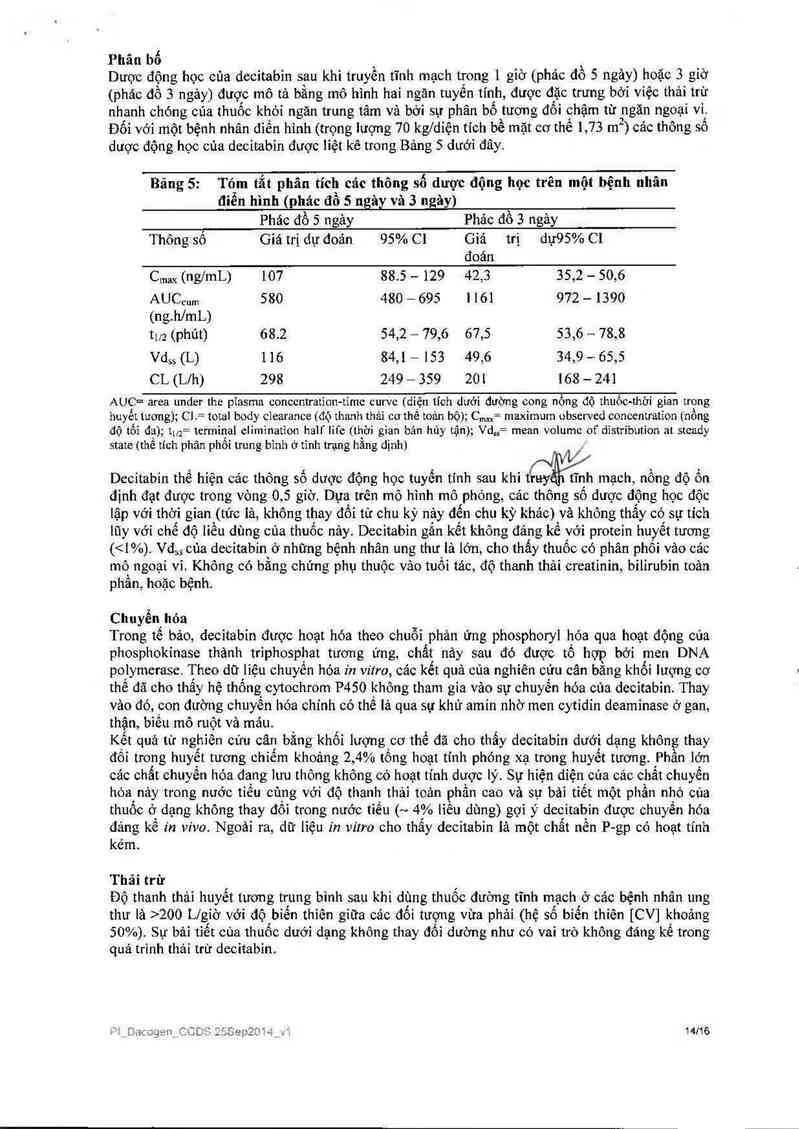
Phân bố
Dược động học của decitabỉn sau khi truyền tĩnh mạch trong ] gỉờ (phác đồ 5 ngảy) hoặc 3 giờ
(phác đồ 3 ngảy) được mô tả bằng mô hình hai ngăn tuyến tính, được đặc trưng bởi việc thải trừ
nhanh chóng cùa thuốc khỏi ngăn trung tâm và bời sự phân bố tương đối chậm từ 2ngăn ngoại vi.
Đối vởỉ một bệnh nhân đìến h1nh (trọng lượng 70 kg/diện tích bề mặt cơ thể 1,73 m ) cạc thông số
dược động học cúa decitabin được iiệt kê trong Bảng 5 dưới đây.
Bảng 5: T6… tắt phân tích các thông số dược động học trên một bệnh nhân
điếu hình (phảc đồ 5 ngây và 3 ngây)
Phác đồ 5 ngảy Phảc đồ 3 ngảy
Thông số Giá trị dự đoán 95% C] Giá trị dự9S% Cl
đoán
Cmax (ng/mL) 107 88.5 — 129 42,3 35,2 — 50,6
AUCcum 580 480 — 695 1161 972 — 1390
(ng.hlmL)
tm (phút) 68.2 54,2 — 79,6 67,5 53,6 — 78,8
Vdss (L) 116 84,1 — 153 49,6 34,9 — 65,5
CL (Llh) 298 249 — 359 201 168 — 24]
AUC= area under the piasma conccntration-timc curvc (diện tích dưới đường cong nổng độ thuốc-thời gian trong
huyết tương); C] — toial body clearance (độ thanh thải co thể toỉm bộ);C .m— maximum observeđ concentration (nồng
độ tối đa); tuz= terminal elimination half life (thời gian bán hùy tận); Vd,,= mean volume of đistribution at stcạdy
state (thể tích phân phối trung binh ớ tinh trạng hằng định) ,
/
Dccitabin thế hiện các thông số dược động học tuyến tính sau khi tigyổi mạch, nồng độ ổn
định đạt được trong vòng 0,5 giờ. Dựa trên mô hình mô phỏng, các thông số dược động học độc
lập vởi thời gian (tửc 121, không thay đổi từ chu kỳ nậy đến chu kỳ khảc) và không thấy có sự tích
lũy với chế độ liếư dùng của thuốc nảy. Decitabin gãn kết không đảng kế với protein huyết tương
(<1%). Vd , cùa decitabin ở những bệnh nhân ung thư là lởn, cho thấy thuốc có phân phối vảo các
mô ngoại vỉ. Không có bằng chứng phụ thuộc vảo tuổi tảc, độ thanh thải creatinin, bilirubin toản
phần, hoặc bệnh.
Chuyến hóa
Trong tế bảo, đecitabin được hoạt hóa theo chuỗi phản ứng phosphoryl hóa qua hoạt động của
phowhokinase thảnh triphosphat tương ửng, chất nảy sau đó được tổ hợp bới men DNA
polymerase. Theo dữ liệu chuyến hóa in vitro, các kết quả của nghiên cứu cân bằng khối iượng cơ
thể đã cho thẳy hệ thống cytochrom P450 không tham gia vâo sự chuyến hóa của decitabin. Thay
vảo đó, _con đường chuyên hóa chinh có thế lả qua sự khứ amin nhờ men cytidin deaminasc ở gan,
thận, bỉếu mô ruột và máu
Kết quả từ nghiên cùu cân bằng khối lượng cơ thế đã cho thẩy decitabỉn dưới dạng không thay
đối trong huyết tương chiếm khoảng 2, 4% tống hoạt tinh phóng xạ trong huyết tương. Phần lớn
cảc chất chuyến hóa đang lưu thông không có hoạt tính dược lý. Sự hỉện diện cùa các chất chuyến
hóa nảy trong nước tiều cùng vởỉ độ thanh thải toản phấn cao và sự bải tiết một phần nhỏ cua
thuốc ở dạng không thay đổi trong nước tiều (~ 4% liếư dùng) gợi ý decitabin được chuyến hớa
đáng kế in w'vo. Ngoài ra, dư lỉệu in vitro cho thấy decitabin là một chất nến P- -gp có hoạt tính
kém.
Thải trừ
Độ thanh thải huyết tương trung bình sau khi dùng thuốc đường tĩnh mạch ở các bệnh nhân ung
thư là >200 L1giờ với độ biến thỉên giữa cảc đối tượng vừa phải (hệ số biến thiên [CV] khoảng
50%). Sự bải tiết của thuốc dưới dạng không thay đổi dường như có vai trò không đảng kế trong
quá trình thải trừ decitabin.
i“: _Cìacogen_C ;,Ẹ:s;t í.'38e0201…,_ Mi 14116
Các kết quả từ một nghiên cứu cân bằng khối lượng cơ thể với hoạt chất đánh dấu phỏng xạ 14-C
decitabin có hoạt tính phóng xạ trong các bệnh nhân ung thư đã cho thấy 90% Iiềư decitabin sử
dụng (4% thuốc dưới dạng không thay đồi) được bải tiết trong nước tiếu.
Dân số đăc biêt
Những ảnh hưởng cùa suy thận hoặc suy gan, tuổi tác, giới tính hay chủng tộc trên dược độnỄ học
của decitabin chưa được nghiên cứu chính thức. Thông tin về nhóm dân số đặc biệt bắt ngu 11 từ
dữ liệu dược động học từ 4 nghiên cứu đã nói ở trên.
Người cao tuổi
Phân tich dân số dược động học cho thấy rằng dược động học của decitabin không phụ thuộc vảo
tuổi tác (dao động nghiên cứu từ 40 đến 87 tuoi, trung bình 70 tuổi).
Suy gan
Chưa có nghiên cứu chính thức về dược động hợc của decitabin ở bệnh nhân suy gan. Kết quả từ
một nghiên cứu cân bằng khối lượng cơ thế và trong cảc thử nghiệm in vitro nêu trên cho thấy
không chắc cảc enzym CYP tham gia vảo sự chuyến hoá của decitabin. Ngoài ra, các dữ 1iệu hạn
chế từ những phân tích dược động học quần thể cho thấy không có cảc thông số dược động học
đảng kể nảo phụ thuộc vảo nồng độ bilirubin toản phần mặc dù có sự dạo động lớn của nồng độ
bilirubin toân phần. Như vậy, nông độ decitabin không có khả năng bị ảnh hưởng ở những bệnh
nhân có suy gan.
Suy thận Ở
Chưa có nghiên cứu chính thức về dược động học của decitabin nhân suy thận. Phân tich
dân số dược động học trên các dữ liệu decitabin hạn chế chỉ ra rằng không có cảc thông số dược
động học đáng kể nảo phụ thuộc vảo độ thanh thải creatinin bình thường, một chỉ số xảc định về
chức năng thận. Như vậy, nồng độ decitabin không có khả năng bị ảnh hưởng ở những bệnh nhân
có chức nãng thận suy giảm.
Nhóm dân số khác
Giới tỉnh
Phân tích dược động học quần thể của decitabin không cho thấy bẩt kỳ sự khác bỉệt liên quan về
lâm sảng nảo giữa nam và nữ.
Chủng tộc
Hầu hết cảc bệnh nhân nghiên cứu lả người châu Âu. Tuy nhiên, phân tích dân số dược động học
cùa decitabin đã chi ra rãng chùng tộc không có ảnh hướng rõ rảng nảo lên nổng độ cùa đecitabin.
THÔNG TIN TIÊN LÂM SÀNG
Chưa có các nghiên cứu chính thức về khả năng sinh ung thư của decỉtabin. Bằng chứng từ y vản
cho thể decitabin có khả năng sinh ung thư. Tải Iiệu hiện có từ các nghiên cứu in vitro và in vivo
cung cap đầy đủ bằng chứng cho thấy decitabin có khả nãng gây tốn hại gen. Tải liệu từ y văn
cũng chứng tỏ decitabin có tác dụng bất lợi lến mọi khía cạnh cùa chu trình sinh sản, bao gổm khả
năng sinh sản, sự phát triến phôi—thai vả sự phát triến sau khi sinh. Các nghiên cứu về độc tính cùa
liếu iặp 1ại trong nhiếu chu kỳ ở chuột cống và thờ đã chứng tỏ độc tính chủ yếu của thuốc nảy lả
ức chế tủy, bao gồm cảc tác động lên tủy xương mã có thể phục hổi khi ngưng trị liệu. Độc tính
trên hệ tiếu hóa cũng được ghi nhận và ở động vật giống đực xảy ra tình trạng teo tinh hoản
không thể phục hồi sau khoảng thời gian phục hồi giả định. Đọc tính của decitabin trên chuột sơ
sinh/chuột con tương tự như ở chuột lớn. Không có ảnh hưởng trên sự phát triến hảnh vi thần kinh
và khả năng sinh sản khi dùng thuốc ở các mức lỉều gây ức chế tủy trên chuột sơ sỉnh/chuột con
m 0… ogen_CCDS 2585²1520'=4_y1 15/16
TỈNH TƯO'N G KY
Vì không có các nghiên cứu về tính tương hợp, không được trộn thuốc nây với các thuốc khác.
Không nên truyền DACOGEN cùng vị trí tiêm/đưòng truyền vởi cảc thuốc khảo.
HAN DÙNG
Lọ thuốc chưa mờ: 3 năm kế từ ngảy sản xuất.
Không dùng thuốc đã quá hạn sử dụng ghi trên nhãn.
Sau khi hoản nguyên: Trừ khi sử dụng ngay sau khi hoản nguyên trong vòng 15 phủt, phải pha
loãng thuốc bằng dung dịch tiêm truyền để iạnh (2°C— 8°C) và bảo quản ở 2°C— 8°C đến tối đa 4
giờ cho đến khi tiêm truyền.
ĐIỀU KIỆN BẢO QUÁN
Lọ thuốc chưa mờ: Bảo quản ở 20C đến 80C.
Xem phần Hạn dùng về điếu kiện bảo quản thuốc đã hoản nguyên.
Để xa tầm tay trẻ em.
QUY CÁCH ĐÓNG GÓI
Hộp ] lọ chứa 50 mg decỉtabin.
HƯỚNG DẤN SỬ DỤNG VÀ xử LÝ VÀ HỦY THUỐC
Thuốc chỉ sử dụng một lần.
Tránh đế da tiếp xúc với dung dịch và phải mang gãng tay bảo vệ. Nên thực hiện cảc qui trinh
chuẩn về sử dụng các thuốc điếu trị ung thư.
Phải hoân nguyên DACOGEN trong điếu kiện vô khuấn với 10 mL nước pha tịềm vô khuẩn. Sau
khi hoản nguyên, mỗi mL chứa khoảng 5,0 mg decitabin ở pH 6,7-7,3. pJ' V /
Ngay sau khi hoản nguyên, phải lập tức pha loãng thêm dung dịch với đn’Ắễ dich Natri clond
0, 9% hoặc Dextrose 5% để có nổng độ thuốc cuối cùng là 0, 1-1,0 mglmL.
Trừ khi sử dụng ngay sau khi hoân nguyên trong vòng 15 phút, phái pha loãng thuốc bằng dung
dịch tiêm truyền để lạnh (2°C— 8°C) và bảo quản ở 2°C— 8°C tối đa 4 giờ đến khi tiêm truyên.
Thuốc không sử dụng hoặc thuốc truyền còn thừa phải được huỷ bỏ theo đúng yếu cầu cùa nước
sở tai.
Sản xuất bởi: Pharmachemie B.V.
Swensweg 5 - 2031 GA Haarlem - Hà Lan
Đóng gói và xuất xưởng bởi: Janssen Pharmaceutỉca N.V.,
Tumhoutseweg 30, B-2340 Beerse, Bi
Công ty đăng ký: JANSSEN- CILAG Ltd. ,Thái Lan
Mọi câu hỏi/Báo cảo tác dụng ngoại ý/Than phiền chất 1ượng sản phẩm xin liên hệ:
VPĐD Janssen-Cilag Ltd., TP Hồ Chí Minh.
ĐT: +84 8 38214828
E-maìl: ịacvndrugsafetv@itsini .com
Phiên bản: CCDS 25Sep2014, số 09
PI_Dacogen_C C DS 2 58ep201 4_v1
Ngòy sừa đổi: 3/3/2015
` wo. cth TRUỜNG
P.TRUỜNG PHÒNG
iạm)ễn 111 ủy Jẳìnỵ
ps _iỉ.=a…gen ,ccos 2586²;32'314 1.» 16116
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng