










fuh nidsdưiu mtúis iGmbtmmilu Imld20 d
0
VIMPATI mmins M multinmúh. N tn Snthln cluih, hMmk
"HH ttcid,utlhtilịưthti Fc’ ltmtiiửylndtiiu núng
sulutinn lot inluiith lnluth uu. ỈOIẸMIIỈ MWMỦJỐỦU.
thosamidu Do lntstoinủtmãO C
' 20 | M“ | | iu `
| _ intiTnsiịousmtinsom n W. V4J Ểu—ỄuuiIauắfflĩvửằĩffll men 1 . `
5 ỉ 200 IglN ill k J lũẾviròtigluwnultuỏum m_vr " “
__ lllllll
VĂN PHÒNG
ĐẠI DIỆN
sd.
::
_! ~c.
`, ..
.'.
`ì
~~` * x
\ ` llllll %
Aescu thnaoomcm G…mH NOỈOZ
' Pmugmg Yocmobgy I … ScnncM Artwudt Studlo checks nnd nptuves Iechnicll occurncy und ple-poeu
A es 'ca m…sunạ to uuitat:ilty ot Ih1s mm onw. Ensure the artwork i… been momugttty
zons Mo…ctm Oơmavy checked lcr textuol eccuraq nnd hu been awroved u ouchi
Product Name Vimpat Print Coiours Tecnn. Colours _ Date Operator Approver
Aesica Id . -No. | VNM , PT ^nDrơý—j _ _ __ __
_ LBL_VIMPATJ OMG/ML_ Dispatched to Kòhier Manufacturi Site
external Id. No. 20ML_VT_MU1 ng
……… _
Opemor Peggy Namaus Fontsize Bodytext 7 pt Linespacing 7 pt
Creation Date 06.11.2013 Technical Changes
Amended by Peggy Nathnus MOCK-UP
Modifio. Date 15.01.2014
Edition No. 02
VPT—Poollĩechntk/ABV_SOP_Vorngi/Fmgabotsiđ/Fmgabeleid_Acslcn_ũờfflt 1
VĂN PHÒNG "
ĐA! DIẸN
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cẩn thêm thông tỉn, xỉn hõỉý
Thuốc nảy chỉ dùng theo đơn của bác sĩ
VIMPAT Dung dịch tiêm truyền
1. TÊN SẢN PHẨM
Vimpat dung dịch tiêm truyền 10 mglml.
2. THÀNH PHÀN VÀ HÀM LƯỢNG
Mỗi ml dung dịch tiêm truyền chứa 10 mg laoosamid.
Mỗi lọ dung tich 20 ml dung dịch tiêm truyền chửa 200 mg lacosamid.
Tá dược có tác dụng đã biết:
Mỗi mi dung dịch tiêm truyền chứa 2,99 mg natri.
Danh sảch đầy đủ các tá dược, xem mục 6.1.
3. DẠNG BÀO CHẾ
Dung dich tiêm truyền. Dung dịch trong, không mảư. i
4. ĐẶC TÍNH LÂM SÀNG
4.1 Chỉ định điều trị
Vimpat được chỉ định điều trị bổ trợ động kinh khởi phảt cục bộ có kèm hoặc không kèm theo động kinh
toản thể thứ phát ở bệnh nhân động kinh người iớn và vị thảnh niên (16- 18 tuổi).
4.2 Liều dùng và cách dùng
Liều dùng
Điều trị với Vimpat có thể bắt đầu bằng đường uống hoặc đường tĩnh mạch.
Sử dụng Vimpat hai lần trong ngảy. Liều khời đẩu được khuyến cảo là 50 mg/lần, uống hai lẩn trong
ngảy, sau một tuần có thể tăng đến mửc liều điều trị là 100 mg/lấn, dùng hai lần trong ngảy.
Điều trị bằng iacosamid cũng có thể bắt đầu với liều đơn khởi đẳu iả 200 mg, sau 12 giờ dùng chế độ liểu
duy trì 100 mg/lần, uống hai lần trong ngảy (200 mglngảy). Liều đơn khởi đầu có thể bắt đầu ở những
bệnh nhân được bác sỹ thấy chắc chắn răng sẽ nhanh chóng đạt được nổng độ iacosamid ỏn đinh trong
huyết tương và hiệu quả điều trị được bảo đảm. Việc dùng liều đơn khời đầu nên được giảm sảt và cân
nhắc do tỷ lệ các phản ứng bất lợi trên thềm kinh trung ương có thể tăng (xem mục 4. 8). Việc dùng liều
đơn khởi đầu chưa được nghiên cứu trong các điếu kỉện câp tính như tinh trạng động kinh.
Tùy theo khả năng dung nạp và đáp' ưng của bệnh nhân, sau mỗi tuần mửc lìều duy tri có thể tãng thêm 50
mg/iần, hai lần trong ngảy cho tới mức Iiều tối đa được khuyến cảo lả 400 mg (200 mg/lần, uỏng hai lần
trong ngảy). Theo thực hảnh lâm sảng hiện tại, nếu phải ngừng thuốc, Vimpat cẩn được ngùng từ từ (ví
dụ giảm dần iiều hảng ngảy với mức giảm là 200 mgltuần).
Cách dùng
Dung dịch tiêm truyền Vimpat cũng được dùng thay thế cho cảo bệnh nhân tạm thời không dùng được
đường uỏng
Dung dịch thuốc được truyền trong khoảng thời gian từ 15 đển 60 phút, hai lần trong ngảy. Dung dịch
tiêm truyền Vimpat có thể được dùng truyên tĩnh mạch mã không cân pha loãng thêm. Việc chuyên đổi
Trang I /` I I
\
Ỉ› ;
giữa đường uống và đường truyền tĩnh mạch có thể thực hiện trực tiếp mà không cẩn dò lỉều. Nên duy trì
tổng liều hảng ngảy vả chê đó dùng hai lẩn trong ngảy.
Đã có kinh nghiệm về việc truyền Vimpat hai lần trong ngảy với thời gian điêu tri kéo dải tới 5 ngây.
Quần thể bênh nhân đăc biêt
Suỵ thân
Không cần hiệu chỉnh liều ở bệnh nhân suy thận nhẹ và vừa (CLCR >30 mllphút). Trên những bệnh nhân
suy thận nhẹ vả vừa, có thể cân nhắc khi dùng liều đơn khởi đầu 200 mg, nhưng nên thận trọng khi hiệu
chỉnh liều (›200 mglngảy) sau đó. Ở những bệnh nhân suy thận nặng (thR sao mllphút) và bệnh nhân
có bệnh lý thận gìai đoạn cuối, liều duy trì tổì đa được khuyến cảo lả 250 mglngảy. Trên những bệnh
nhân nảy, nên thận trọng khi hiệu chỉnh lìều. Nếu cần dùng liều đơn khởi đẩu, nên dùng liều ban đẩu là
100 mg, tiếp theo di… chế độ liều 50 mgllần, hai lẫn/ngảy trong tuần đầu tiên. Với cảc bệnh nhân đang
thẩm phân máu, liều bỄ sung bằng 50% 1iêu điều trị hảng ngảy (liều đã chia) nên được dùng ngay sau khi
thẩm phân máu. Cần thận trọng khi điều trị cho các bệnh nhân có bệnh lý thận giai đoạn cuối vi có rất ít
kinh nghiệm lâm sảng và có sự tích lũy chất chuyến hóa (chưa rõ tác dụng dược iý) ở những bệnh nhân
nay.
S_uưffl
Không cần hiệu chỉnh liều ở bệnh nhân suy gan nhẹ và vừa.
Nếu những bệnh nhân nảy còn có bệnh lý suy thận mắc kèm, vìệc dò liều cần được thực hiện một cảch
thận trọng. Có thể xem xét dùng liều đơn khởi đầu 200 mg, nhưng nên thận trọng khi hiện chinh liều
(>200 mg/ngảy) sau đó. Dược động hỌC của lacosamid trên bệnh nhân suy gan nặng chưa được đảnh giả
(xem mục 5.2).
Ngỵòt' cao tuồi (trẻn 65 tuốiị
Không cần giảm liều ở bệnh nhân cao tuổi. Kinh nghiệm điều trị bệnh nhân cao tuổi bị động kinh bằng
lacosamiđ còn hạn chế. Ở những bệnh nhân nây cần cân nhắc sự liên quan giữa tuổi tảo với giảm độ thanh
thải thận và tăng mức AUC (xem mục “Sử dụng thuốc ở bệnh nhân suy thận’ ởtrên và xem mục 5.2).
Trẻ em
Không nên sử dụn Vimpat cho trẻ em và thanh thiếu niên dưới 16 tuổi vì chưa có dữ liệu về mức độ an
..
toản và hiệu quả đ i Vơi lứa tuối nảy.
4.3 Chống chỉ định
Mẫn cảm vởi hoạt chất hoặc bất cứ thảnh phần tá dược nảo được liệt kê trong mục 6.1.
Block nhĩ thất độ hai hoặc độ ba.
4.4 Các chú ý đặc biệt và thận trọng khi sử dụng
Chỏng măt
Điều trị bằng Iacosamid có thể gây chóng mặt, điểu nảy có thể lâm tăn nguy cơ chấn thương đo tai nạn
hoặc té ngả. Vì vậy, bệnh nhân cân được khuyên nên thận trọng cho đen khi quen với những ảnh hướng
có thể xảy ra cùa thuốc (xem mục 4.8).
Nhig tim và dẫn truỵền tim
Một số nghiên cứu iâm sâng đã ghi nhận iạcosamid_kéo dải khoảng PR. Với những bệnh nhân có rối loạn
dẫn truyen hoặc bệnh tim nặng nhưcó tiên sử nhôi máu cơ tim hoặc suy tim cân thận trọng khi dùng
iacosamid. Đặc biệt thận trọng khi điêu trị cho bệnh nhân cao tuổi vì những bệnh nhân nảy có nguy cơ rôi
loạn tim mạch cao hoặc thận trọng khi sử dụng đồng thời lacosamid với những thuốc có iiên quan tới việc
kéo dải khoảng PR.
Trang 2 / II
l/.h` `
Biock nhĩ thắt độ hai hoặc cao hon đã được báo cảo trong quá trinh lưu hảnh thuốc Rung nhĩ hoặc cuồng
nhĩ chưa được ghi nhận khi sử dụng lacosamid để điều trị cho bệnh nhân động kinh trong cảc thử nghiệm
lâm sảng có đối chúng gìả dược; tuy nhiên cả hai tình trạng trên đều được bảo cảo trong cảc nghiên cứu
lâm sảng động kỉnh nhãn mờ vả trong quá trình lưu hânh thuốc (xem mục 4. 8)
Bệnh nhân cần được thông báo về oảo triệu chứng cùa block nhĩ thẳt độ hai hoặc cao hợn (ví dụ như nhịp
tim chậm hoặc nhịp không đểu, cảm giác choáng váng vả ngất xĩu) vả cảc triệu chứng cũa rung nhĩ,
cuồng nhĩ (ví dụ như đảnh trống ngực nhịp tim nhanh hoặc rối loạn nhịp tỉm, khó thở). Bệnh nhân nên
tìm kiểm tư vắn chuyên môn y tế khi gặp cảc triệu chửng nảy
Ý đinh và hânh vi tư từ
Ý định và hảnh vi tự tử đã được bảo cáo ở những bệnh nhân đỉếu trị bằng thuốc chống động kinh trong
một số chỉ định Kểt quả phân tích gộp cảc thử nghiệm lâm sảng phân nhóm ngẫu nhiên có đôi chửng giả
dược cùa cảc thuốc chống động kinh cho thấy tăng nhẹ nguy cơ tăng ý định vả hảnh vì tự tử. Cơ chế của
nguy cơ nảy hiện chưa được sảng tò vả dựa trên cảc dữ lỉệu hiện tại thì không loại trừ khả năng nguy cơ
tăng iả do iacosamid
Vì vậy, cần kỉếm soát các dẩn hiệu y định và hảnh vi tự tử cũa bệnh nhân, đồng thời cần xem xét cảc bỉện
phảp diễu trị phù hợp. Bệnh nhân (vả những người chăm sóc bệnh nhân) nên tìm kiểm tư vấn chuyên môn
y tế khi xuất hiện các dấu hiệu của ý định vả hảnh vì tự từ (xem mục 4. 8).
Thuốc chứa 2, 6 mmol (hoặc 59, 8 mg) natri trong mỗi lọ. Nên cân nhắc khi sử dụng thuốc cho bệnh nhân
cần kiếm soát iượng muôi.
4.5 Tương tảc vởi các thuốc khác và các dạng khác của tương tác
Lacosamiđ cần sử dụng thận trọng trên những bệnh nhân đang đỉều trị bằng những thuốc có liên quan đến
việc kéo dải khoảng PR (ví dụ như carbamazepin, lamotrigin, pregabalin) và trên những bệnh nhân đang
điếu trị bằng thuốc chống ioạn nhịp tim nhóm 1 Tuy nhiên, kết quả phân tích duớỉ nhóm ở những bệnh
nhân sử dụng đồng thời lacosamid vởi carbamazepin hoặc lamotrigin trong các thử nghiệm lâm sâng
không phát hiện kéo dải khoảng PR
(
Dữ Iiêu in vitro
Nhin chung dữ 1iệu cho thẩy lacosamỉd có khả năng tương tảo thẳp. Cảo nghiên cứu in vitro chi ra rằng
các enzym CYP1A2, 286 và 2C9 không bị cảm ửng, CYPIAI,1AZ,2A6,2B6,2C8,2C9,2D6 vả 2E1
không bị ức chế bời lacosamid ở nông độ tương đương với nồng độ trong huyết tương ghi nhận được
trong các thử nghỉệm lâm sảng. Một nghiên cứu in vitro oho thấy iacosamid không được vận chuyến bời
P-giycoprotein ở ruột. Dữ Iiệu in vitro cho thấy CYP2C9, CYP 2C19 vả CYP3A4 có khả nãng xúc tác
cho sự tạo thảnh dẫn chất chuyến hỏa O- -dcsmcthyl cùa lacosamid.
Dữ Iiêu in vỉvo
Lacosamid không' ưc chế hoặc oảm ứng CYP2C19 vả CYP3A4 ở mức độ có ý nghĩa lặm sảng. Lacosamid
không ảnh hướng đến AUC cùa midazolam (chuyển hóa bởi CYP3A4, lacosamid uống 200 mg, hai lần
trong ngảy) nhưng C,… cũa midazoiam tăng nhẹ (30%). Lacosamid không ảnh hưởng đên dược động học
cùa omeprazol (chuyển hóa bởi CYP2C19 vả 3A4, lacosamid uống 300 mg, hai lần trong ngảy).
Omeprazoi, chất gây ức chế CYP2C19 (40 mg uống một lần trong ngảy), không lâm tăng có ý nghĩa lâm
sảng tông lượng iacosamid trong tuần hoản. Do đó những chắt ức chế trung binh enzym CYP2C19 dường
như không ảnh hưởng có ý nghĩa lâm sảng đến tổng iượng lacosamỉd.
Cần thận trọng khi phối hợp điều trị vởi những chất ức chế mạnh CYP2C9 (ví dụ như fluoonazoi) vả
CYP3A4 (ví dụ như itraconazoi, ketoconazol, rítonavir, clarithromycin), vì sự phối hợp nảy có thể lảm
tăng tống lượng lacosamid. Nhũng tương tảo nảy chưa được ghi nhặn m vivo nhưng có thể xây ra dựa trên
dữ liệu in vitro
Trang 3 .v’ 11
He?/
Những thuốc gây cảm ứng enzym mạnh như rifampicin hoặc cây có ban (Hypericum perforatum) có thế
lảm giảm trung binh tống lượng lacosamid trong tuần hoân. Do vậy, cân thận trọng khi bắt đẩu hoặc
ngừng điều trị với những thuốc gây cảm ứng enzym nây.
Các thuốc chống đông kinh
Trong các thử nghiệm về tương tác thuốc, lacosamid ảnh hưởng không đáng kể đến nồng độ trong huyết
tương cùa carbamazepin vả acid valproic. Nồng độ cùa iacosamid trong huyết tương cũng không bị ảnh
hướng bới carbamazepin vả acid valproỉc Một phân tích động học quân thể ước tính rằng khi sử dụng
lacosamid cùng với ỉnhững thuốc chống động kinh khảo dã được biêt đến iả những chất gây cảm ứng
enzym (carbamaze n,phenytoin, phenobarbitai, với các mửc liều khảo nhau) iảm giảm 25% tổng lượng
Iacosamid trongt hoản.
Thuốc tránh thai đuờng uống
Trong một thử nghiệm về tương tảo thuốc, không ghi nhận được tương tác có ý nghĩa lâm sảng giữa
lacosamid vả cảc thuốc tránh thai đường uống ethinylestradiol vả Ievonorgestrel. Nong độ progesteron
không bị ảnh hướng khi uống đồng thời các thuốc nảy với lacosamid.
Các tương tác khác
Cảo thử nghiệm về tương tảo thuốc cho thấy Iacosamid không ảnh hưởng đến dược động học của digoxin.
Không ghi nhận được tương tác cóý nghĩa lâm sảng giữa lacosamid vả metfonnin.
Không có dữ liệu về tương tác giữa lacosamid với rượu.
Tỷ lệ iiên kết với protein huyết tương cùa iacosamid thấp hơn 15%. Do đó, đườn như không xảy ra
những tương tác có ý nghĩa iâm sảng với thuôc khác thông qua cạnh tranh vị trí iiên ket với protein.
4.6 Khả năng sinh sản, phụ nữ có thai và cho con bú
Phu nữ có thai
Efflv cơ Iiẻn auan đến đỏmz kinh vả thuốc chống đông kinh nói chung
Với tặt cả các thuốc chống động kinh, tỷ lệ dị tật ở trẻ em sinh ra từ mẹ được điều trị động kinh lớn hơn
hai đến ba lần so với tỷ lệ 3% ở người bình thường. Trong số những người được điều tri, dị tật gia tăng
đáng chú’ y ở những người sử dụng nhiều hơn một thuốc, tuy nhiên, tỷ lệ dị tật do điếu trị vâ/hoặc do bệnh
chưa được lảm sáng tỏ.
Hơn thế nữa, để đảm bảo hiệu quả, việc điều trị chống động kinh không được gián đoạn, vì tình trạng
nặng thêm của bệnh gây bất lợi cho cả mẹ và thai nhi.
Eggv cơ Iíẻn quan đến lacosamid
Khônchỏ đầy đủ dữ liệu về việc sử dụng lacosamid ở phụ nữ có thai. Những nghiên cứu trên động vật
cho thây không xuất hiện ảnh hưởng gây quái thai ở chuột và thò, nhưng độc tính vởi phôi đã được ghi
nhận trên chuột và thờ ở liếu gây độc cho mẹ (xem mục 5.3). Nguy cơ tiềm ấn trên người chưa được biết
đên.
Không nên sử dụng lacosamid trong thai kỳ, trừ khi thực sự cần thiết (nểu lợi ích cho mẹ vượt trội hơn so
với nguy cơ với bảo thai). Nếu người phụ nữ quyết định sẽ mang thai, cần dảnh giá lại cẩn thận việc sử
dụng thuốc nảy.
Đang cho con bú
Hiện chưa rõ iacosamid có được bải tiết vảo sữa mẹ ở người hay không. Những nghiên cứu trên động vật
cho thấy có sự bâi tiết lacosamid vảo sữa mẹ. Do đó, đề thận trọng,n nên ngừng cho con bú trong thời gian
đíều trị bằng lacosamid.
Trang 4 I ]
II "|
Khả năng sinh sân
Ành hưởng bất lợi đến khả năng sinh sản cùa chuột đực vả chuột cái chưa được ghi nhận ở mức liều tạo
ra tổng lượng thuốc trong huyết tương (AUC) cao gấp khoảng 2 lần AUC huyết tương của người khi sử
dụng mức liếu điều trị tối đa được khuyến cảo (MRHD)
4. 7 Ảnh hưởng trên khả năng lái xe vận hânh máy móc
Vimpat có thể ảnh hướng nhẹ hoặc trung bình đến khả năng iải xe và vận hảnh máy móc. Điều trị bằng
Vimpat iiên quan đến chóng mặt hoặc nhìn mờ.
Do đó, bệnh nhân được khuyến cáo không nên lải xe ô tô hoặc vận hảnh những mảy móc có khả năng gây
nguy hiếm khảo cho đến khi quen với những ảnh hưởng của Vimpat lên khá nảng thực hiện những hânh
vi trên.
4.8 Tác dụng không mong muốn
Tỏm tắt hồ sơ an toân
Dựa trên phân tich gộp cảc thử nghiệm iâm sảng có sử dụng đối chửng giả dược trên 1.308 bệnh nhân
động kinh khới phảt cực bộ, tổng oộng 61,9% số bệnh nhân được phân nhóm ngẫu nhiên dùng lacosamid
và 35, 2% số bệnh nhân được phân nhóm ngẫu nhiên dùng giả dược báo cáo có it nhất một phản ứng bất
lợi. Phản ứng bất lợi được bảo cảo nhiều nhất ở những người điều tư bằng lacosamid bao gồm chỏng mặt,
nhức đầu, buổn nôn và nhìn đôi. Phản ứng bất lợi thường có cường độ nhẹ đến trung bình. Một sô phản
ứng bất lợi phụ thuộc liều và có thể giảm nhẹ bằng việc giảm Iiều. Tỷ lệ mắc và mức độ nghiêm trọng của
cảc phản' ưng bất lợi trên thần kinh trung ương và đường tiêu hóa thường giảm theo thời gian.
Trong tất cả cảc nghiên cứu có kiểm soát, tỷ lệ ngừng thuốc do cảc phản ứng bất iợi là 12,2% với bệnh
nhân được phân nhóm ngẫu nhiên dùng lacosamid và 1,6% với bệnh nhân được phân nhóm ngẫu nhiên
đùng giả dược. Phản ứng bất lợi phổ biến nhất dẫn đến việc ngừng thuốc' ơ nhỏm điều trị bằng lacosamid
iả chóng mặt.
Cảo phản ứng bất lợi trên hệ thần kinh trung ương như chóng mặt có thể tăng lên sau khi dùng iiều đơn
khởi đầu.
Bâng danh sách các ghân ứng bẩt lơi
Tần số xuất hiện các phản ứng bất lợi được bảo cảo trong phân tích gộp cảc thử nghiệm lâm sảng có s
dụng đối chứng giả dược và trong quá trình iưu hảnh thuốc được chi ra trong bảng dưới đây (với tỷ lệ mắc
>1% trong nhóm dùn iacosamid và tỷ lệ nảy >1% so với nhóm dùng giả dược). Tần số xuất hiện được
định nghĩa như sau: rât phổ biến (,zlllO), thường gặp (>1/100 đến <1/10), it gặp (>1/1 000 đến <1/100) và
chưa biết rõ (tần suất không thể ước tính được từ cảc dữ liệu sẵn có). Trong mỗi nhóm, phản' ưng bất iợi
được trinh bảy theo thứ tự giảm dần của mức độ nghiêm trọng. "
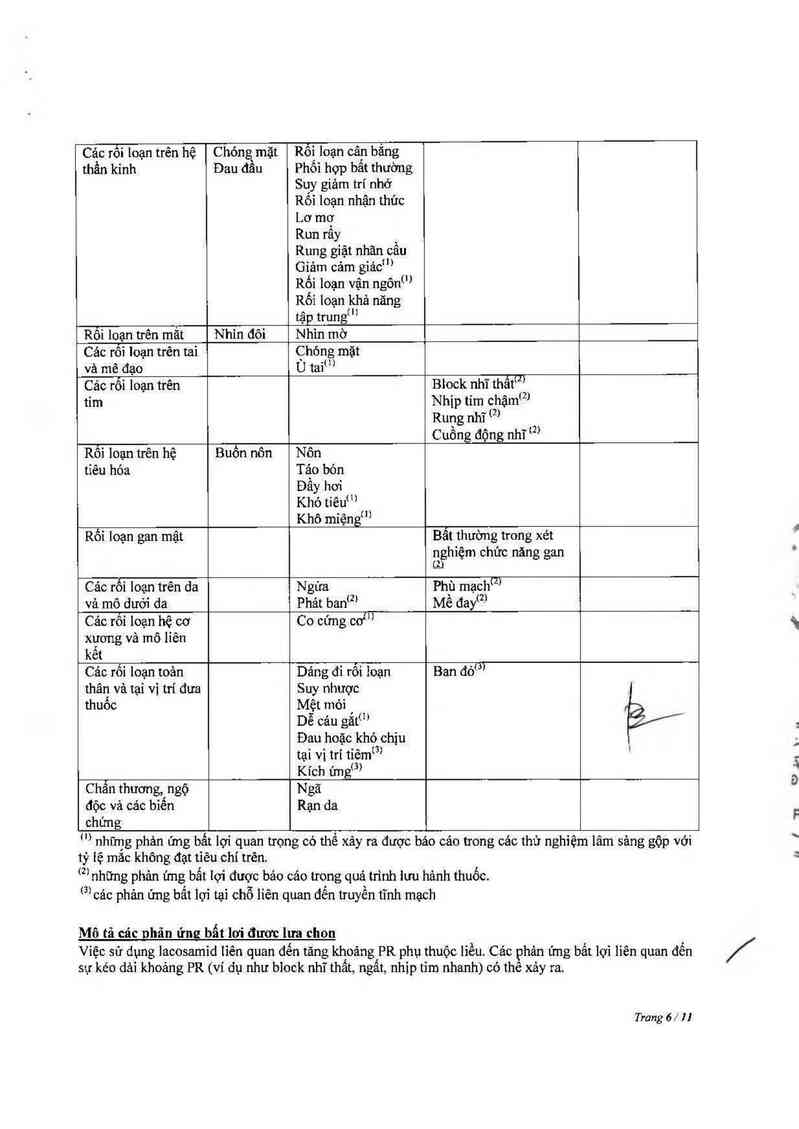
Phân Ioại theo hệ Rẩt hỗ Thường gặp Ít gặp Chưa biết rõ
cơ tLuan bien
Rối loạn trên máu Mât bạch cầu
và bạch huyêt hạtm
Rối Ioạn trên hệ Quả mẫnm
thống miễn dịch
Rối Ioạn tâm thẩn Trầm cảm Gây sựffl
Lú iẫn… Kich dộng…
Mất ngùm Tâm trạng phấn khích…
Rối loạn tâm Iym
Hảnh vi tự tử ’
Ý định tự tứm
Ảo giác…
Trang5/II
Ấ“\
n'
chứng
Cảc rối loạn trên hệ Chóng` mặt Rối loạn cân bắng
thần kỉnh Đau đâu Phôi hợp bât thường
Suy giảm trí nhớ
Rối loạn nhận thức
Lơ mơ
Run rấy
Rung giật nhãn cầu
Giảm cảm gỉảcm
Rối loạn vận ngônm
Rối loạn khả năng
tập trungí "
Rối loạn trên mắt Nhin đôi Nhìn mờ
Các rôì loạn trên tai Chóng mặt
và mê đạo Ù tai…
Cảo rối loạn trên Block nhĩ thất…
tim Nhịp tim chậmf²J
Rung nhỉ (²)
Cuồng động nhĩ …
Rối loạn trên hệ Buổn nôn Nôn
tiêu hóa Tảo bón
Đầy hơi
Khó tiêu…
Khô miệngm
Rối loạn gan mật Bắt thường trong xét
nghìệm chức năng gan
@)
Cảo rối loạn trên đa Ngứa Phù mạchm
và mô dưới da Phảt banm Mễ đay®
Cảc rôí loạn hệ cơ Co cứng cơ…
xương và mô lỉên
kết
Các rối loạn toản Dảng đi rối Ioạn Ban đó…
thân và tại vị trí đưa Suy nhược
thuốc Mệt mòi
Dễ cảu gắt…
Đau hoặc khó chịu
tại vị trí tiêmm
Kích ứng…
Chẳn thương,, ngộ Ngã
độc và cảc biến Rạn da
… những phản ứng bất lợi quan trọng có thể xảy ra được báo cáo trong các thử nghiệm lâm sảng gộp vởi
tỷ iệ măc không đạt tỉêu chí trên.
(²)
1
Mô tả các nhản ứng bất lơi đươc lưa chon
Việc sử đụng lacosamid Iiên quan đến tăng khoảng PR phụ thuộc liều. Các phản ứng bất lợi lỉẽn quan đến
những phản ứng bẩt lợi được bảo cáo trong quá trình lưu hảnh thuốc.
3’ các phản ứng bất lợi tại chỗ liên quan đên truyền tĩnh mạch
sự kéo dải khoảng PR (ví dụ như biock nhĩ thẩt, ngất, nhịp tỉm nhanh) có thẻ xảy ra.
Trang 6 / II
/
ÙJfl\~ .
Trong các thử nghiệm lâm sảng trên bệnh nhân động kinh, tỷ lệ mắc block nhĩ thẩt độ một được bảo cáo
là ít gặp, tỷ lệ lân lượt là 0,7%, 0%, 0 ,5%, 0% tương ứng lacosamid 200 mg, 400 mg, 600 mg và giả
dược. IKhông gặp trường hợp block nhĩ thất độ hai hoặc cao hqn trong các nghiên cứu nảy. Tuy nhiên,
một sô ca block nhĩ thất độ hai và đó ba liên quan đến đỉễu trị bằng lacosamid đã được báo cáo trong quá
trình lưu hảnh thuốc.
Trong cảc thử nghiệm lâm sảng, tỷ lệ ngắt ít gặp và không khảc nhau giữa nhóm bệnh nhân động kinh
điều trị bằng lacosamid (0,1%) và nhóm bệnh nhân dùng giả dược (0, 3%).
Rung nhĩ hoặc cưồng nhĩ không được bảo cảo trong cảc thử nghiệm lâm sảng ngắn hạn; tuy nhìên cả hai
phản ứng bất lợi nảy đều được báo cáo trong thứ nghỉệm động kỉnh nhãn mở và trong quá trình lưu hảnh
thuốc.
Kết guả xét nghiêm bẩt thường
Bất thường trong xét nghiệm chức nãng gan đã được ghi nhận trong cảc thử nghiệm lâm sâng có kiềm
soát với lacosamid ở bệnh nhân người lớn mắc động kinh khói phảt cục bộ, những người sử dụng 1 đến 3
thuốc chống động kinh đồng thời. ALT tăng cao hơn 3 lần giới hạn trên cùa giá trị bình thường
(>3xULN) được ghi nhận với tỷ lệ 0,7% (71935) số bệnh nhân điểu trị bằng Vimpat và 0% (0/356) sô
bệnh nhân dùng giả dược.
Phản ứng guá mẫn đa cơ guan
Phản ứng quá mẫn đa cơ quan đã được báo cáo ở cảc bệnh nhân điều trị bằng một số thuốc chống độn
kinh. Nhũng phản ứng nảy biểu hiện đa dạng nhưng thường xuất hiện kèm theo sốt, phát ban và có the
xáy ra ở nhiều hệ cơ quan khảo nhau. Những ca điển hình được bảo cáo lả hiếm gặp với lacosamid. Nên
ngừng sử dụng lacosamid nếu nghi ngờ xảy ra phản ứng quá mẫn trên nhiều cơ quan.
4.9 Quả liều
Kình nghiệm lâm sảng về quá liều lacosamid trên người còn hạn chê.
Triêu chứng
Các trìệu chứng lâm sảng (chóng mặt vả buồn nôn) khi sử dụng liều 1200 mg/ngây chủ yếu liên quan đến
hệ thần kinh trung ương, hệ tiêu hóa vả được giải quyết bằng cách điều chính liều.
Quá liều cao nhất ẤĂđược bảo cảo trong chương trình phát triển lâm sảng của lacosamid lả 12 g uống kểt
hợp với nhiều thuốc chống động kinh khảo ở liều độc. Đối tượng ban đầu xuất hiện hôn mê, sau đó hổi
phục hoản toản và không để lại di chứng.
Xứ lv
Không có thuốc giải độc đặc hiệu trong trường hợp quá liều lacosamid. Điều trị quá liều Iacosamid bao
gôm các biện phảp hỗ trợ toản thân vả có thể thấm phân máu trong trường hợp cần thiết (xem mục 5.2).
s. ĐẶC TÍNH DƯỢC LÝ
5.1 Đặc tính dược lực học
Nhóm dược lý điều tri: các thưốc chống động kỉnh khác, mã ATC: NO3AX l 8,
Hoạt chất lacosamide (R—2-acetamido-N-benzyl-3-methoxypropỉonamide) lả một chất acid amin có chức
năng.
Cơ chế tác dung
Cơ chế chính xác về tảc dụng chổng động kinh của lacosamid ở người còn đang tíếp tục được lảm rõ.
Cảc nghiên cứu điện sinh lý học in vìtro cho thấy lacosamid lảm tăng có chọn lọc sự bẫt hoạt chậm cùa
kênh calci phụ thuộc điện thế, kết quả lảm on định mảng tế bảo thần kinh bị kich thích quá mức.
Trang 7/ I I
Tác dung dươc lưc
Lacosamíd bảo vệ chống lại cơn động kinh trên nhiều mô hình động vật bị gây cơn động kinh cục bộ và
động kỉnh toản thế vả lảm trì hoãn sự phát triến kich thich
Kết quả nghiên cứu t1en lâm sảng cho thấy phối hợp lacosamid với levetỉracetam, carbamazepin,
phenytoin, valproat, lamotrigin, topiramat hoặc gabapentỉn cho thấy tảc dụng hiệp đồng cộng hoặc hiệp
đồng vượt mức hìệu quả chống co giật
Hiên cmả lâm sảng vả đô an toân
Hỉệu quả cùa việc sử đụng Vimpat đế điếu tri bộ trợ ở mức lỉếu khuyến cảo (200 mglngảy, 400 mg/ngảy)
đã được thỉết lập đựa trên kết uả 3 thử nghiệm iâm sảng ngẫu nhiên có sử dụng đoi chửng giả dược vói
thời gian đỉều trị kéo dải 12 tuan. Vimpat 600 mg/ngảy cũng thể hiện hiệu quả trong thử nghiệm điếu trị
bổ trợ có kiểm soát, tuy nhiên hiệu quả nảy tương tự mức liêu 400 mglngây vả bệnh nhãn tỏ ra dung nạp
kém hơn do cảc phản ứng bất lợi trên thần kinh trung ương vả tiêu hóa. Do dó, mức liều 600 mgln`
không được khuyến cảo. Liều tối đa được khuyến cảo lẻ 400 mglngảy. Nhũng thử nghiệm nảy bao gom
1308 bệnh nhân vởi tiển sứ động kinh khởi phát cục bộ trung bình 23 năm, được thiết kế để đảnh giá hiệu
quả và độ an toản cùa lacosamid khi dùng đồng thời với 1- 3 thuốc chống động kinh khác trên những bệnh
nhân động kinh khởi phát cục bộ khôn kiếm soát kèm theo hoặc không kèm theo động kinh toân thề.
Nhìn chung tỷ lệ bệnh nhân giảm 50% tan suất động kỉnh lần lượt là là 23%, 34% và 40% tương ửng với
giả dược, lacosamid 200 mg/ngảy vả lacosamid 400 mglngảy.
Hiện không đủ dữ liệu để có thể rủt các thuốc chống động kinh dùng phổi hợp để sử dụng đơn trị lỉệu
bằng lacosamid.
Dược động học và độ an toản cùa lacosamid truyền tĩnh mạch vởi liếu đcm khởi đầu được đánh giá trong
một thử nghiệm lâm sảng đa trung tâm, nhãn mở. Thử nghiệm nảy được thiểt kể để đảnh giá độ an toản
và khả năng dung nạp cùa lacosamid tác dụng nhanh Sử dụng liều đơn khỏi đầu đương truyền tĩnh mạch
(liều 200 mg) sau đó tiếp tục dùng liều uỏng hai lần/ngảy (tương ứng vởỉ lỉếu truyền tĩnh mạch) trong
điều trị bổ trợ cho bệnh nhân động kinh khớỉ phảt cục bộ từ 16-60 tuôi.
5.2 Đặc tính dược động học (
Hố thu
Sau khi truyền tĩnh mạch, nổng độ thuốc tối đa trong huyết tương đạt được ở cuối gíaỉ đoạn truyền. Nổng
độ thuốc trong huyết tương tăng tỷ lệ vởi liều dùng sau khi uỏng (100- -800 mg) và sau khi truyền tĩnh
mạch (50- 300 mg).
Phân bố
Thể tich phân bổ xấp xỉ 0,6 L/kg. Tỷ lệ liên kết vởi protein huyết tương cùa lacosamid thấp hơn 15%.
Chuvến hỏa
95% lỉều uống được bảỉ tỉết trong nước tiều ở dạng nguyên vẹn và các chất chuyến hóa. Chuyến hóa cùa
lacosamid còn chưa được nghiên cứu đẩy đủ
Chẩt chinh được bâi tiết trong nước tiếu lả lacosamid 0 dạng nguyên vẹn (khoảng 40% liều uống) và dẫn
chất chuyển hỏa O- desmethyl của nó (thấp hơn 30%).
Một phần cảc chất phân cực được dự kỉến lá các dẫn xuất cùa serin chiếm khoảng 20% trong nước tiếu,
tuy nhiên chỉ một lượng nhỏ (0-2%) được phảt hiện trong huyết tương người ở một số đối tượng. Lượng
nhỏ (0, 5- -2%) các chất chuyến hóa khảo được tim thấy trong nước tiểu.
Dữ liệu in virro cho thẩy CYP2C9, CYP2C19 vả CYP3A4 có khả nâng xúc tảo sự tạo thảnh chất chuyền
hỏa O- -desmethyl nhưng lsoenzym đóng vai trò chĩnh chưa được xảo định trên in vỉvo. Không có sự khảo
biệt có ý nghĩa lâm sảng về tổng lượng lacosamid trong tuần hoản 0 nhóm chuyển hỏa bình thường (EM,
Trang 8 «' I I
CYP2C19 hoạt động chức năng) và nhóm chuyến hỏa kém (PM, thíếu CYP2C19 hoạt động chức năng.
Hơn thế, thứ nghỉệm đánh gỉá tương tác vởi omeprazol (một chất ức chế CYP2C19) cho thấy sự thay đoỉ
nồng độ lacosamid trong huyết tương không có ý nghĩa lâm sảng chứng tỏ răng tầm quan trọng của con
đường chuyển hóa nảy là rất nhớ Nồng độ cùa O- desmethyl-lacosamid trong huyết tương bằng khoáng
15% nông độ lacosamid trong huyết tương. Chưa biểt rõ tác dụng dược lý của chất chuyến hóa chỉnh nảy.
T_h__ải trừ
Lacosamỉd được thải trừ khỏi hệ tuẫn hoản chủ yếu bằng con đường bải tiết qua thận và chuyển hóa sinh
học. Sau khi uống và tỉêm tĩnh mạch lacosamid đã đảnh dấu phóng xạ, khoảng 95% chất đảnh dẩu phóng
xạ được tìm thấy trong nước tiền và ít hơn 0, 5% được tìm thấy trong phân. Thời gỉan bán thải của thuốc ở
dạng nguyên vẹn khoảng 13 gìờ. Dược động học phụ thuộc liêu vả không đổi thco thời gian, sự biến thiện
dược động học trong cùng một cả thế vả giữa các cá thế ít. Sau liếu uỏng hai lần trong ngảy, nồng dộ ốn
định trong huyết tương đạt được sau 3 ngảy. Nồng độ trong huyết tương tăng với hệ sô tích iũy khoảng 2.
Liều đơn khởi đấu 200 mg có nồng độ ở trạng thái òn đình tương ứng với mức liều đường uống 100 mg,
uống hai lần trong ngảy.
Dươc đông hoc ởguần thể bênh nhân đãc hiêt \
Gi_ơi___ tính
Cảc thử nghiệm lâm sảng cho thấy giới tính không có ảnh hưởng đáng kể có ý nghĩa lâm sâng đến nồng
độ lacosamid huyết tương.
Suv thân
AUC của lacosamid tăng khoảng 30% ở bệnh nhân suy thận nhẹ vả trung bình, 60% ở bệnh nhân suy thận
nặng và bệnh nhân có bệnh lý thận gỉai đoạn cuối đang thấm phân rnáu so vởi người khỏe mạnh, trong khi
đó Cmax không bị ảnh hưởng.
Thẩm phân máu có thế loại bỏ phẩn lón lacosamid ra khỏi huyễt tương. Sau mỗi 4 giờ thấm phân mảư,
AUC cùa lacosamid giảm khoảng 50%. Do đó lỉều bổ sung được dùng ngay sau khi thẩm phân mảư được
khuyến cảo (xem mục 4. 2). Tống lượng chắt chuyến hóa O-đesmethyl tăng gấp vải lẩn ở những bệnh
nhân suy thận trung bình vả suy thặn nặng. Ở nhũng bệnh nhân có bệnh lý thận gíai đoạn cuội không
thẩm phân máu, tổng lượng nảy tăng và tỉếp tục tăng trong suốt 24 giờ lẩy mâu. Chưa biết vỉệc tảng tống
lượng các chẩt chuyến hỏa ở bệnh nhãn có bệnh lý thặn giai đoạn cuối có lảm tăng phản ứng bất lợi hay
không nhưng cảc chất chuyến hóa đã được xác định là không có hoạt tính
Su an
Bệnh nhân suy gan trung bình (Child-Pugh B) có nổng độ lacosamid huyết tương cao hơn (cao hơn
khoảng 50% so với AUC binh thường). Lượng cao hơn nảy một phần do chửc năng thận của cảc đối
tượng nghiên cứu bị suy gỉãm. Độ thanh thải ngoải thận giảm ở các bệnh nhân trong nghỉên cứu ước tính
gây tăng 20% AUC cùa lacosamid. Dược động học của lacosamid chưa được đảnh giả ở bệnh nhân suy
gan nặng (xem mục 4.2).
NQ'ười cao ruốz' ftrên 65 tuồiị
Trong một nghiên cứu thực hiện trên nam giới vả nữ giởi cao tuổi gồm 4 bệnh nhân >75 tuổi, AUC tăng
lần lượt khoảng 30% và 50% so với nam giởi trẻ tuồỉ. Điều nảy một phẫn liên quan đến trỌng lượng cơ
thể thẳp hơn. Sự khác biệt sau khi đã hiệu chỉnh theo trỌng lượng cơ thể tương ứng lả 26% và 23%. Sự
tăng biến đồi trong tống lượng lacosamid cũng được ghi nhận. Trong nghiên cứu nây, độ thanh thải thận
cùa lacosamid chỉ giảm nhẹ ở người cao tuổi.
Nguyên tắc giảm iiều chung không nhẩt thiết cẩn phải cân nhắc trừ khi bệnh nhân có suy giảm chức năn g
thận (xem mục 4.2).
Trang 9 X 11
5 3 Dữ Iiệu an toân tiền lâm sâng
Trong các nghiên cứu về độc tính, nồng độ lacosamid huyết tương thu được chỉ tương đương hoặc cao
hơn chút it so với nồng độ ghi nhận ở bệnh nhân, dẫn đến không xác định được gỉới hạn về tống lượng
phơi nhiễm thuốc hoặc giới hạn nảy rẫt thấp
Một nghiên cứu về độ an toản dược lý khi tiêm tĩnh mạch lacosamid ở chó đã gây mê cho thấy khoảng PR
và phức bộ QRS tăng trong khoảng thời gian ngắn và huyếtá aẵi giảm có thể do ức chế tim. Sự tăng nảy bắt
đầu ở dải nông độ tương tự với nông dộ sau khi uống iiều t đa được khuyến cáo Ộ chó đã gâ mê và
khi đuôi dâi, với liều tiêm tĩnh mạch 15- 60 mg/kg, đã ghi nhận được sự giảm dẫn tmyền nhĩ vả th t, block
nhĩ thắt vả nhĩ thất phân ly.
Trong các nghiên cứu độc tính liều lặp lại, những thay đổi nhẹ, có hồi phục trên gan được ghi nhận ở
chuột bắt đầu từ mức iiều gấp khoảng 3 lần tổng lượng phơi nhiễm trên lâm sâng. Những thay đổi nảy
bao gồm tăng trọng lượng gan, phì đại các tế bảo gan, tăng nồn độ cảc enzym gan trong huyết thanh,
tăng cholesterol toân phần và tăng triglycerid. Ngoài phi đại các te bảo gan, những thay đối mô bệnh học
khảo chưa được ghi nhận.
Trong các nghiên cứu về độc tính trên sinh sản và phảt triến ở các loâi gặm nhấm vả thỏ, 1iều gây độc mẹ
trên chuột cong tương ứng với mức tống lượng hệ thống bằng tổng lượng lâm sảng kỳ vọng không gây
hiện tượng quải thai nhưng lảm tăng sô lượng chuột con bị chết trong bụng mẹ vả chết trong thời gian
sinh nở, lâm giảm nhẹ sô lượng con sống sót và trọng lượng cơ thể con. Mức tống lượng cao hơn không
thể thứ nghìệm trên động vặt vi gây độc mẹ, do đó dữ lỉệu hiện chưa đủ để mô tả đầy đủ khả năng gây
độc phôi và gây quải thai của Iacosamid.
Những nghiên cứu trên chuột cho thắy Iacosamid vả/hoặc các chất chuyển hóa của nó dễ dảng vượt qua
hảng rảo nhau thai.
Đánh g'á rũi ro môi trường ịERA)
Sử dụng Vimpat phù hợp với thông tin sản phấm không dẫn đến những tác động không thể chấp nhận
được đên môi trường.
6. ĐẶC TÍNH DƯỢC PHẨM
6.1 Danh mục cảc tá dược
Nước cất pha tỉêm
Natri clorid
Acid hydrochloric (để điều chĩnh pH)
6.2 Tương kỵ
Không trộn lẫn thuốc nảy với các thuốc khác trừ các thuốc được đề cập đến ở mục 6.6.
6.3 Hạn sử dụng
36 thảng kể từ ngảy sản xuất.
Độ ổn định về mặt hóa học và vật lý của thuốc đã được chứng minh trong vòng 24 giờ ở nhiệt độ lên đến
25°C khi thuốc được trộn với các chất pha loãng trong mục 6. 6.
Do vẩn đề về mặt vi sinh, thuốc nên được sử dụng ngay. Nếu không sử dụng ngay, thời gian và đìếu kiện
bảo quản trước khi sử dụng thuộc về trách nhiệm cùa người sử dụng và không nên vượt quá 24 giờ ở 2
đền 8°C, trừ khi dung dịch sau khi pha loãng đã được kiểm soát và đảm bảo được điểu kiện vô khuân.
6.4 Các chú ý bảo quản đặc biệt
Không bảo quản thuốc ở nhiệt độ trên 30°C.
Trang 10/ II
6.5 Nguồn gốc và thânh phần bao bì
Lọ thùy tinh loại 1 không mâu với nắp cao su chiorobutyl được bao ngoải băng f1uoropolymer.
Hộp 5 ống tiêm dung tích 20 ml.
6.6 Các chú ý đặc biệt về tiêu hũy thuốc và xử lý khác
Thuốc chỉ dùng một lần, nên loại bỏ bất cứ phần dung địch nảo không được sử dụng.
Không nên sử dụng các thuốc bi vần đục hoặc mất mâu. Dung dịch tiêm truyền Vimpat tương hợp về vật
lý và bền vững về mặt hóa học khi trộn với các chất pha loãng dưới đây trong ít nhất 24 giờ khi được bảo
quản trong lọ thùy tinh hoặc túi PVC ở nhiệt độ lên đến 25°C.
Cảo chất gha Ioãne:
Dung dịch natri clorid 9 mglml (0.9%) để tiêm truyền.
Dung dich glucose 50 mglml (5%) để tiêm truyền.
Dung dịch Ringer lath để tiêm truyền.
Bất cứ phần thuốc nảo không được sử dụng hoặc cảc chất thải nên được xử lý phù hợp với quy định tại
địa phương.
7. CHU sơ HỮU GIẤY PHÉP VÀ NHÀ SẢN XUẤT
Chủ sở hữu giấy phép:
UCB Pharma GmbH
Alfted-Nobel-Str. 10, D-40789 Monheim am Rhein, Germany (Đức).
Sản xuất và đỏng gỏi sơ cấp:
UCB Pharma S.A.
Chemin du Foriest, B-1420 Braine l’Alleud, Belgium (Bi).
Đóng gói thứ cấp:
Aesica Phannaceuticals GmbH,
Mittelstr. 15, 40789 Monheim am Rhein, Germany (Đức).
8. NGÀY HIỆU CHỈNH VĂN BẢN
Ngảy 7 tháng 1 năm 2014.
Q. cục TRUỞNG
P.TRƯỞNG PHÒNG
«Ấỷayễn tyẳly cfflềìĩấ
Trong II / II
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng